Kohlensäuredimethylester
Kohlensäuredimethylester oder Dimethylcarbonat ist eine organische chemische Verbindung, die als Dimethylester der Kohlensäure gesehen werden kann.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
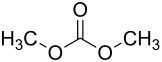 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kohlensäuredimethylester | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C3H6O3 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit angenehmem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 90,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,07 g·cm−3 (20 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,3687 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung und Gewinnung
Dimethylcarbonat kann in einer Zweiphasenreaktion durch Umsetzung von Methanol mit Phosgen oder Methylchlorformiat in konzentrierter Natronlauge gewonnen werden.[6] Eine modernere Synthese verläuft als direkte oxidative Carbonylierung von Methanol mittels Kohlenmonoxid und Sauerstoff in Gegenwart von Kupferkatalysatoren.[7][8]
Eigenschaften
Physikalische Eigenschaften
Dimethylcarbonat ist eine leichtentzündliche, farblose Flüssigkeit. Bei Normaldruck siedet die Verbindung bei 90 °C.[9] Der kritische Punkt wird bei einer Temperatur Tc = 284 °C und einem Druck Pc = 48 bar mit einer kritischen Dichte von 3,97 mol·l−1 erreicht.[10]
Sicherheitstechnische Kenngrößen
Dimethylcarbonat bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 14 °C.[2][11] Der Explosionsbereich liegt zwischen 3,26 Vol.‑% (122 g/m³) als untere Explosionsgrenze (UEG) und 12,87 Vol.‑% als obere Explosionsgrenze (OEG).[2] Die Sauerstoffgrenzkonzentration liegt bei 8,0 %.[12] Die Zündtemperatur beträgt 458 °C.[2][11] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
Im Gemisch mit Ethylencarbonat wird die Verbindung in nichtwässrigen Elektrolytlösungen für Lithiumbatterien verwendet.[13] In der organischen Synthese wird Dimethylcarbonat als Methylierungsreagenz eingesetzt. Außerdem ersetzt es zunehmend das sehr giftige Phosgen bei der Herstellung von Polycarbonat-Kunststoffen.[14] Die Verwendung als Kraftstoffkomponente wird diskutiert.
Einzelnachweise
- Eintrag zu DIMETHYL CARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- Eintrag zu Dimethylcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 24. Februar 2021. (JavaScript erforderlich)
- Datenblatt Kohlensäuredimethylester (PDF) bei Merck, abgerufen am 19. Januar 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-196.
- Eintrag zu Dimethyl carbonate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- H.-J. Buysch, H. Krimm, H. Böhm: EP21211 (Bayer 1979).
- L. Cassar: Chim. Ind. Milan. Band 72, 1990, S. 18.
- U. Romano, F Rivetti: Europäisches Patent 365 083 A1 (Enichem Synth. 1988).
- Yan Xing, Dongbei Shao, Wenjun Fang, Yongsheng Guo, Tuisen Lin: Vapor pressures and flash points for binary mixtures of tricyclo[5.2.1.02.6]decane and dimethyl carbonate. In: Fluid Phase Equilibria. Band 284, 2009, S. 14–18. doi:10.1016/j.fluid.2009.06.002.
- W. V. Steele, R. D. Chirico, S. E. Knipmeyer, A. Nguyen: Vapor Pressure, Heat Capacity, and Density along the Saturation Line, Measurements for Dimethyl Isophthalate, Dimethyl Carbonate, 1,3,5-Triethylbenzene, Pentafluorophenol, 4-tert-Butylcatechol, α-Methylstyrene, and N,N‘-Bis(2-hydroxyethyl)ethylenediamine. In: J. Chem. Eng. Data. Band 42, 1997, S. 1008–1020. doi:10.1021/je970102d.
- Chemsafe Datenbank für sicherheitstechnische Kenngrößen im Explosionsschutz, PTB Braunschweig/BAM Berlin, abgerufen am 24. Februar 2021.
- Mitu, M.; Brandes, E.; Zakel, S.; Hirsch, W.: Explosion regions and limiting oxygen concentrations of methyl propionate, methyl acetate, dimethyl carbonate with air and inert gas mixtures in J. Loss Prev. Proc. Ind. 69 (2021) 104384, doi:10.1016/j.jlp.2020.104384.
- M. S. Ding, K. Xu, T. R. Jow: J. Electrochem. Soc. Band 147, 2000, S. 1688.
- Ernest Foy, Joseph B. Farrell, Clement L. Higginbotham: Synthesis of linear aliphatic polycarbonate macroglycols using dimethylcarbonate. In: Journal of Applied Polymer Science. Band 111, 2009, S. 217–227, doi:10.1002/app.28887.
