Mechanostat
Mit Mechanostat bezeichnet man ein Modell, welches den Knochenumbau (Modeling und Remodeling) beschreibt. Es wurde 1960 von Harold Frost im Utah Paradigm of Skeletal Physiology[1][2][3][4][5] aufgestellt und stellt eine Ergänzung des Wolffschen Gesetzes dar.
Demnach wird Knochenwachstum und Knochenabbau durch die maximale elastische Verformung des Knochens bestimmt. Grund für die Verformung des Knochens sind die auftretenden kurzzeitigen Maximalkräfte (in vivo messbar beispielsweise mittels Mechanographie und Quantitativen Computertomographie). Dieser Vorgang (Regelkreis) findet ein Leben lang statt. Der Knochen adaptiert also seine mechanische Funktion, das heißt seine Geometrie und damit die Knochenfestigkeit, ein Leben lang auf die täglichen Anforderungen. Dementsprechend besteht im gesunden Regelkreis Muskel-Knochen ein linearer Zusammenhang zwischen Muskelquerschnittsfläche (als Surrogat für die typische Maximalkraft des Muskels) und Knochenquerschnittsfläche (als Surrogat für Knochendichte)[6][7].
Diese Tatsache hat gerade auch für den Knochenschwund (Osteoporose) Konsequenzen, da diesem durch geeignetes Training, welches die benötigten Spitzenkräfte zur Stimulation des Knochenwachstums erzeugt, entgegengewirkt werden kann, beispielsweise das Vibrationstraining.
Modeling und Remodeling
Frost spricht von vier Bereichen der elastischen Knochenverformung (Strain - Definition siehe unten) die zu unterschiedlichen Konsequenzen führen:
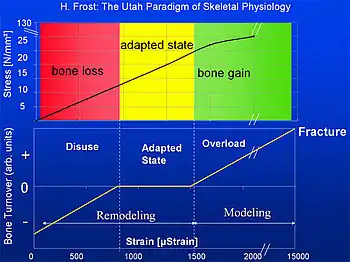
- Disuse:
Strain < circa 800 μStrain: Remodeling (Knochenumbau und Knochenreparatur) findet statt, Knochenmasse und Knochenfestigkeit wird abgebaut - Adapted State:
strain zwischen ca. 800 μStrain und ca. 1500 μStrain: Remodeling (Knochenumbau und Knochenreparatur) findet statt, Knochenmasse und Knochenfestigkeit bleibt unverändert - Overload:
Strain > circa 1500 μStrain: Modeling (Knochenaufbau) findet statt, Knochenmasse und Knochenfestigkeit wird vergrößert - Fracture:
Strain > circa 15.000 μStrain: Bruchgrenze, der Knochen bricht.
Somit besitzt der typische Knochen, beispielsweise die Tibia, einen Sicherheitsfaktor von etwa 5 bis 7 zwischen maximaler typischer Verformung (maximal 2000 bis 3000 μStrain) und seiner Bruchgrenze (circa 15.000 μStrain)
Einheit: Strain E
Die Verformung der Knochen wird in μStrain[2][3] gemessen, wobei 1000 μStrain = 0,1 % Längenänderung entsprechen.
- Strain E bei Länge l und Längenänderung Δl:
Zu berücksichtigen ist hierbei, dass die Festigkeit des Knochens stark von der Geometrie und von der Richtung der Krafteinleitung abhängig ist. Die Tibia beispielsweise hat in axialer Richtung etwa eine Bruchgrenze vom 50- bis 60-fachen Körpergewicht. Senkrecht zu dieser Achse liegt die Bruchgrenze jedoch um den Faktor 10 oder mehr niedriger.
Unterschiedliche Knochen können durchaus unterschiedliche Modeling- und Remodeling-Schwellen aufweisen. Für die Tibia liegt die Modeling-Schwelle beispielsweise bei ca. 1500 μStrain (= 0,15 % Längenänderung), am Schädelknochen hingegen liegt die Schwelle etwa um den Faktor 6 bis 8 niedriger. Da sich die reinen Materialeigenschaften, wie beispielsweise Dichte und Festigkeit, dieser beiden Knochen nicht unterscheiden, bedeutet dies, dass der Schädelknochen im Vergleich zur Tibia einen deutlich höheren Sicherheitsfaktor (also Bruchgrenze im Vergleich zur typischen Belastung) besitzt, denn bei niedriger Modelingschwelle führen schon deutlich kleinere tägliche Kräfte zu „dickeren“ Knochen.
Beispiele
Typische Beispiele für den Einfluss der Maximalkräfte und der daraus resultierenden Verformungen auf den Regelkreis Muskel-Knochen sind Langzeitraumfahrer und Patienten mit einer Querschnittlähmung nach einem Unfall (Paraplegiker). So werden bei einem Rollstuhlfahrer Muskeln und Knochen im unbenutzten Beinbereich drastisch abgebaut, während im vielgenutzten Armbereich Muskeln und Knochen erhalten oder gar aufgebaut werden[8][9]. Derselbe Effekt tritt auch bei Langzeitastronauten ein[10], da diese aufgrund der fehlenden Schwerkraft im All ebenfalls keine ausreichenden Maximalkräfte auf die Knochen insbesondere des Beinbereichs ausüben können.
Wäre für den Zustand des Knochens rein die Knochenmasse ausschlaggebend, so würde jeder Langzeitastronaut und jeder Rollstuhlfahrer unter Osteoporose leiden. In der Tat handelt es sich aber in beiden Fällen nicht um einen erkrankten Knochen, sondern lediglich um den fehlenden Stimulus für die Anregung von Knochenerhalt bzw. Knochenwachstum durch Maximalkräfte bzw. die daraus resultierende Verformung der Knochen. Dies belegt auch die Tatsache, dass Muskel- und Knochenverluste bei Langzeitastronauten nach der Rückkehr auf die Erde bei ausreichender Trainingsdauer wieder vollständig kompensiert werden.
Weblinks
- ISMNI – International Society of Musculoskeletal and Neuronal Interactions
Literatur
- Frost H.M.: Defining Osteopenias and Osteoporoses: Another View (With Insights From a New Paradigm), Bone 1997, Vol. 20, No. 5, 385–391, PMID 9145234
- Frost H.M.: The Utah Paradigm of Skeletal Physiology Vol. 1, ISMNI, 1960
- Frost H.M.: The Utah Paradigm of Skeletal Physiology Vol. 2, ISMNI, 1960
- Frost H.M.: The Utah paradigm of skeletal physiology: an overview of its insights for bone, cartilage and collagenous tissue organs, J Bone Miner Metab. 2000; 18:305–316, PMID 11052462
- Frost H.M., Schoenau E.: The muscle-bone unit in children and adolescents: a overview, 2000, J. Pediatr Endorcrinol Metab 13:571–590, PMID 10905381
- Schoenau E., Neu C.M., Beck B., Manz F., Rauch F.: Bone Mineral content per Muscle Cross-Sectional Area as an Index of the Functional Muscle-Bone Unit, J Bone Mineral Res, Vol. 17, S. 1095–1101, 2002, PMID 12054165
- Schießl H., Frost H.M., Jee W.S.S.: Estrogen and BoneMuscle Strength and Mass Relationships, Bone, Vol. 22, S. 1–6, 1998, PMID 9437507
- Eser P. et al.: Relationship between duration of paralysis and bone structure: a pQCT Study of spinal cord injured individuals, Bone, Vol. 34, S. 869–880, 2004, PMID 15121019
- Eser P. et al.: Bone Loss and Steady State after Spinal Cord Injury: A Cross Sectional Study Using pQCT, J Muskuloskel Neuron Interact, Vol. 4, S. 197–198, 2004, PMID 15121019
- Blottner D., Salanova M., Püttmann B., Schiffl G., Felsenberg D., Buehring B., Rittweger J.: Human skeletal muscle structure and function preserved by vibration muscle exercise following 55 days of bed rest, Eur J. Appl Physiol, 2006, Vol. 97, S. 261–271, PMID 16568340