Kaliumcitrat
Kaliumcitrat ist das Kaliumsalz der Citronensäure. Es ist ein weißes, leicht hygroskopisches, geruchloses Pulver mit leicht salzigem Geschmack. Es wird in der Medizin, der Lebensmitteltechnik sowie in der Pharma- und Kosmetikindustrie eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
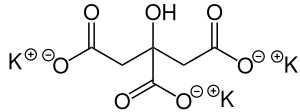 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Kaliumcitrat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H5K3O7 · H2O | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose, hygroskopische Kristalle[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A12BA02 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,98 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
>230 °C (Zersetzung)[3] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Darstellung
Industriell wird Kaliumcitrat aus Citronensäure synthetisiert, welche möglicherweise unter Einsatz gentechnisch veränderter Organismen gewonnen wird.[5]
Verwendung
Medizin
Kaliumcitrat wird vorwiegend zur Behandlung von Nierensteinen eingesetzt. Es wird vom Körper nach oraler Zufuhr sehr schnell aufgenommen; ein Übermaß an Kalium- oder Citrationen wird über den Urin wieder ausgeschieden. Kaliumcitrat ist eine wirksame Vorbeugung gegen Nierensteine aus Harnsäure (eine Begleiterscheinung bei Gicht), Cystin oder Calciumoxalat, wobei das Wirkprinzip bei den organischen Steinen die Alkalisierung des Urins, und bei Oxalat die Erhöhung der Löslichkeit durch Komplexierung ist. Die Wirksamkeit gilt nicht für alle Steinzusammensetzungen. Eine Studie an 500 Patienten mit wiederkehrenden Nierensteinen hat gezeigt, dass sich durch Behandlung mit Kaliumcitrat die durchschnittliche Anzahl an Steinen pro Jahr von zwei auf einen halben reduzieren ließ.[6][7][8]
Ähnlich vielen anderen Kaliumsalzen kann Kaliumcitrat Herzrhythmusstörungen verhindern, die durch Kaliummangel im Blut hervorgerufen werden. Außerdem ist für Kaliumcitrat in klinischen Studien nachgewiesen, dass es dem Calciumverlust über die Niere und dem Calciumabbau aus den Knochen entgegenwirkt.[9][10][11] So zeigte eine prospektive kontrollierte Interventionsstudie bei 161 postmenopausalen Frauen mit Osteopenie, dass die partielle Neutralisierung einer diätinduzierten Säurebelastung (mittels 30 mmol Kalium aus Kaliumcitrat pro Tag, entspricht 3,24 g Kaliumcitrat) über einen Zeitraum von zwölf Monaten die Knochendichte signifikant erhöhte und die Knochenstruktur deutlich verbesserte. Kaliumcitrat wirkte dabei genauso effektiv wie Raloxifen, ein Östrogen-Rezeptor-Modulator, der bei der Behandlung und Prävention von Osteoporose bei postmenopausalen Frauen eingesetzt wird.[9] Außerdem hat Kaliumcitrat eine blutdrucksenkende Wirkung und reduziert den Blutdruck nachweislich genauso effektiv wie Kaliumchlorid.[12]
Lebensmitteltechnik
Kaliumcitrat findet als Säuerungsmittel und Säureregulator, sowie als Komplexbildner oder Schmelzsalz Verwendung. Es findet sich oft als Säuerungsmittel in Getränken wie Limonaden oder wird bei der Gelierung mit Pektin eingesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 332 ohne Höchstmengenbeschränkung (quantum satis) für alle Lebensmittel allgemein zugelassen.
Handelsnamen
- Kalium Verla (D)
- Urocit (CH)
Weblinks
- zusatzstoffe-online.de: E 332 - Kaliumcitrat
- Artikel zur Medikation bei Nierensteinen
Einzelnachweise
- Eintrag zu E 332: Potassium citrates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu POTASSIUM CITRATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Juli 2020.
- Datenblatt Tripotassium citrate monohydrate, 99+% bei AlfaAesar, abgerufen am 26. Dezember 2019 (PDF) (JavaScript erforderlich).
- Externe Identifikatoren von bzw. Datenbank-Links zu Kaliumcitrat-Monohydrat: CAS-Nummer: 6100-05-6, EG-Nummer: 612-062-1, ECHA-InfoCard: 100.127.864, PubChem: 2735208, ChemSpider: 2016906, Wikidata: Q27133400.
- transGEN: Zitronensäure E 330
- Sakhaee K, Nicar M, Hill K, Pak CY: Contrasting effects of potassium citrate and sodium citrate therapies on urinary chemistries and crystallization of stone-forming salts. In: Kidney Int. 24, Nr. 3, September 1983, S. 348–352. PMID 6645208.
- Ettinger B, Pak CY, Citron JT, Thomas C, Adams-Huet B, Vangessel A: Potassium-magnesium citrate is an effective prophylaxis against recurrent calcium oxalate nephrolithiasis. In: J. Urol. 158, Nr. 6, Dezember 1997, S. 2069–2073. PMID 9366314.
- Robinson MR, Leitao VA, Haleblian GE, et al.: Impact of long-term potassium citrate therapy on urinary profiles and recurrent stone formation. In: J. Urol. 181, Nr. 3, März 2009, S. 1145–1150. doi:10.1016/j.juro.2008.11.014. PMID 19152932.
- Jehle S et al.: Partial neutralization of the acidogenic western diet with potassium citrate increases bone mass in postmenopausal women with osteopenia. In: J Am Soc Nephrol. (2006) 17: 3213–3222, PMID 17035614.
- Marangella M et al.: Effects of potassium citrate supplementation on bone metabolism. Calcif Tissue Int (2004) 74: 330–335, PMID 15255069.
- Sellmeyer DE et al.: Potassium citrate prevents increased urine calcium excretion and bone resorption induced by a high sodium chloride diet. J Clin Endocrinol Metab (2002) 87: 2008–2012, PMID 11994333.
- He et al.: Effect of short-term supplementation of potassium chloride and potassium citrate on blood pressure in hypertensives. In: Hypertension. (2005) Apr;45(4):571-4, PMID 15723964.