Isobutanal
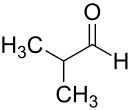
Isobutanal (nach IUPAC-Nomenklatur: 2-Methylpropanal, auch als Isobutyraldehyd bekannt) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Aldehyde. Isobutanal ist u. a. ein natürlicher Bestandteil in Bananen.[5] Neben dem verzweigten Isobutanal existiert noch die isomere Verbindung Butanal (Butyraldehyd). Isobutanal ist ein Zwischenprodukt der chemischen Industrie.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Isobutanal | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H8O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 72,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
64 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (75 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,374 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−247,3 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Großtechnisch wird Isobutyraldehyd durch Hydroformylierung von Propen mithilfe metallorganischer Cobalt- oder Rhodiumverbindungen als Katalysator bei Temperaturen von 130 – 160 °C und Drücken von 100 – 200 bar hergestellt.[6][7]
Darüber hinaus kann es durch Oxidation von Isobutanol (2-Methylpropan-1-ol) synthetisiert werden. Diese Methode findet jedoch keine Anwendung, da Isobutanol technisch erst durch Reduktion (Hydrierung) von Isobutanal hergestellt wird. Isobutanal entsteht außerdem bei der thermischen Zersetzung von Isobutylidendiharnstoff.
Eigenschaften
Physikalische Eigenschaften
Isobutanal ist eine leicht flüchtige, lichtempfindliche, luftempfindliche, leichtentzündliche, farblose Flüssigkeit mit stechendem Geruch, welche mäßig löslich in Wasser ist. Sie siedet bei Normaldruck bei 64 °C.[2] Die molare Verdampfungsenthalpie beträgt am Siedepunkt 33,4 kJ·mol−1.[8] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,87395, B = 1060,141 und C = −63,196 im Temperaturbereich von 286 bis 336 K.[9] Sie besitzt eine dynamische Viskosität von 0,5 mPa·s.[2]
Sicherheitstechnische Kenngrößen
Isobutanal bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −24 °C.[2][10] Der Explosionsbereich liegt zwischen 1,6 Vol.‑% (47 g/m3) als untere Explosionsgrenze (UEG) und 11 Vol.‑% (330 g/m3) als obere Explosionsgrenze (OEG).)[2] Die Grenzspaltweite wurde mit 0,92 mm bestimmt.[2][10] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2] Die Zündtemperatur beträgt 165 °C.[2][10] Der Stoff fällt somit in die Temperaturklasse T4.
Verwendung
Isobutanal ist ein Ausgangsmaterial zur Herstellung von Valin durch die Strecker-Synthese:
-
- Isobutanal reagiert mit Ammoniak und Cyanwasserstoff zu Valin und Wasser.
sowie von Neopentylglycol über eine Cannizzaro-Reaktion. Außerdem kann es bei der Knoevenagel-Reaktion eingesetzt werden.
Weiterhin ist es ein Zwischenprodukt für Arzneistoffe (z. B. D-Penicillamin[11]) und von Schädlingsbekämpfungsmitteln.
Ein großer Teil wird auch durch katalytische Hydrierung zu Isobutanol weiterverarbeitet.[6]
Biologische Bedeutung
Isobutanal kommt als Aromastoff in Honig vor.
Abgeleitete Verbindungen
- Isobutyraldehyd-di(2-ethylhexyl)acetal, Zusatzstoff für Bohrspülungen
- 2,2,4-Trimethyl-1,3-pentandiolmonoisobutyrat, Koaleszenzmittel
Einzelnachweise
- Eintrag zu 2-METHYLPROPANAL in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Mai 2021.
- Eintrag zu Isobutyraldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Dezember 2018. (JavaScript erforderlich)
- Datenblatt Isobutyraldehyde bei Sigma-Aldrich, abgerufen am 29. September 2010 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-26.
- R. Tressl, F. Drawert, W. Heimann, R. Emberger: Notizen: Gasehromatographische Bestandsaufnahme von Bananen-Aromastoffen. In: Zeitschrift für Naturforschung B. 24, 1969, S. 781–783 (online).
- Eintrag zu Butyraldehyde. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. November 2018.
- Eintrag zu ISOBUTYRALDEHYDE in der Hazardous Substances Data Bank, abgerufen am 7. Februar 2019 (online auf PubChem).
- Wojtasinski, J.G.: Measurement of Total Pressures for Determining Liquid-Vapor Equilibrium Relations of the Binary System Isobutyraldehyde n-Butyraldehyde in J. Chem. Eng. Data 8 (1963) 381–385, doi:10.1021/je60018a028.
- Seprakova, M.; Paulech, J.; Dykyj, J.: Dampfdruck der Butyraldehyde in Chem. Zvesti 13 (1959) 313–316.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Wolfgang M. Weigert, Heribert Offermanns und Paul Scherberich: D-Penicillamine – Production and Properties. In: Angewandte Chemie International Edition in English. 14, 1975, S. 330–336, doi:10.1002/anie.197503301. PMID 808979.

