N-Glykosylierung
Die N-Glykosylierung (synonym N-Glycosylierung) ist eine co- und posttranslationale Modifikation, bei der Kohlenhydrate (Glykosylgruppen) an Aminogruppen (N-) von Proteinen angehängt werden.
Eigenschaften
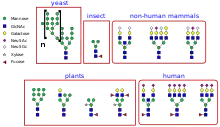
Die N-Glykosylierung ist eine Form der Glykosylierung, bei der die Glykosylgruppen mit der Seitenkette von der Aminosäure Asparagin (Asn) in Proteinen kovalent verbunden werden. Sie kommt in allen Lebewesen vor. Das Asparagin liegt dabei in der Erkennungssequenz (synonym dem Sequon) Asn-X-Ser/Thr, mit X für eine beliebige Aminosäure außer Prolin (Pro), Serin (Ser) und Threonin (Thr).[1] Innerhalb einer Art kommen teilweise unterschiedliche N-Glykosylierungen vor, die unter anderem vom Zelltyp abhängen.[1] Im Gegensatz zur N-Glykosylierung wird bei der O-Glykosylierung die Glykosylgruppe auf die Hydroxygruppe der Seitenkette der Aminosäuren Serin oder Threonin übertragen.
Biosynthese
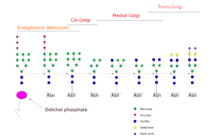
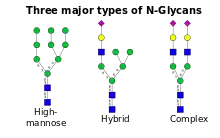
Die Synthese des N-Glykosylierungsvorläufers erfolgt durch verschiedene Transferasen an Dolicholpyrophosphat im Endoplasmatischen Retikulum. Der Vorläufer wird nach der Synthese en bloc auf das Protein durch die Oligosaccharyltransferase übertragen.[2] Nach der Übertragung werden die Glucosereste durch Glucosidasen und zum Teil Mannosereste entfernt, sodass das Grundgerüst übrig bleibt.[3] Das erste Kohlenhydrat an der Aminogruppe eines glykosylierten Asparagins ist ein N-Acetylglucosamin (GlcNAc) in β-Konfiguration.[1] Darauf folgen ein weiteres N-Acetylglucosamin und drei Mannosen (Man) als Grundstruktur der N-Glykosylierung, an der anschließend verschiedene Modifikationen erfolgen. Das Protein gelangt über den sekretorischen Weg für die anschließenden Modifikationen in den Golgi-Apparat. Dort entsteht aus der Grundstruktur ein hochmannosylierter Typ, der Hybridtyp oder der Komplextyp.[4]
Literatur
- D. Voet, J. Voet: Biochemistry, 4. Aufl., Wiley, Weinheim 2011. ISBN 978-0-47057095-1.
Einzelnachweise
- K. Drickamer, M. E.: Taylor Introduction to Glycobiology. 2. Ausgabe. Oxford University Press, 2006. ISBN 978-0-19-928278-4.
- Daniel J. Kelleher, Reid Gilmore: An evolving view of the eukaryotic oligosaccharyltransferase. In: Glycobiology. Band 16, Nr. 4, 1. April 2006, ISSN 1460-2423, S. 47R–62R, doi:10.1093/glycob/cwj066 (oup.com [abgerufen am 9. November 2020]).
- Jürgen Roth: ProteinN-Glycosylation along the Secretory Pathway: Relationship to Organelle Topography and Function, Protein Quality Control, and Cell Interactions. In: Chemical Reviews. Band 102, Nr. 2, Februar 2002, ISSN 0009-2665, S. 285–304, doi:10.1021/cr000423j (acs.org [abgerufen am 17. Februar 2021]).
- Stefan Wildt, Tilllman U. Gerngross: The humanization of N -glycosylation pathways in yeast. In: Nature Reviews Microbiology. Band 3, Nr. 2, Februar 2005, ISSN 1740-1534, S. 119–128, doi:10.1038/nrmicro1087 (nature.com [abgerufen am 17. Februar 2021]).