Gattermann-Synthese
Bei der Gattermann-Synthese handelt es sich um eine Namensreaktion der Organischen Chemie, die zur Herstellung von aromatischen Aldehyden aus Phenolen oder anderen Aromaten verwendet wird. Sie wurde 1906 von dem Goslarer Chemiker Ludwig Gattermann (1860–1920) entdeckt und wird auch als Gattermann-Aldehydsynthese bezeichnet. Diese Variante der Friedel-Crafts-Acylierung kann auch eingesetzt werden, um einzelne Kohlenwasserstoffverbindungen, Heterocyclen wie Furan-, Pyrrol- und Indolderivate sowie Thiophen zu synthetisieren.
Übersichtsreaktion
Bei der Gattermann-Reaktion reagieren Aromaten (außer aromatische Amine und Nitroverbindungen) mit Blausäure und Chlorwasserstoff in Gegenwart des Katalysators Zinkchlorid (ZnCl2) oder Aluminiumchlorid (AlCl3) zu aromatischen Aldehyden.[1]
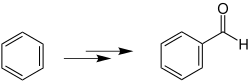
Mechanismus
Die Gattermann-Reaktion ist eine elektrophile aromatische Substitution.[2] Ein möglicher Mechanismus[3][4] soll am Beispiel von Blausäure, Chlorwasserstoff und Benzol gezeigt werden, die zu Benzaldehyd (5) reagieren. Als Katalysator kommt hierbei Zinkchlorid zum Einsatz. Im ersten Schritt greift das freie Elektronenpaar des Stickstoffs das Wasserstoffatom des Chlorwasserstoffs an. Es bildet sich ein Formimidchlorid, das mit dem Katalysator zum Komplex 1 reagiert. Durch weitere Zugabe von Zinkchlorid entsteht ein Carbeniumion, das das Elektrophil zur elektrophilen aromatischen Substitution als nächsten Schritt darstellt. Das Carbeniumion und das Benzol gehen eine Wechselwirkung ein, sodass sich ein mesomeriestabilisierter σ-Komplex 2 bildet. Nach der anschließenden Deprotonierung wird die Verbindung 2 rearomatisiert und durch die Zugabe von Chlorwasserstoff zu einem Iminiumsalz 3 umgesetzt. Im nächsten Schritt erfolgt eine Hydrolyse und eine anschließende Protonenwanderung, sodass ein α-Aminoalkohol 4 entsteht. Die Ladung am Stickstoffatom in 4 polarisiert die C-N-Bindung, sodass das Kohlenstoffatom eine positive Partialladung erhält und damit die O-H-Bindung polarisiert. Ein Proton und ein Ammoniak-Molekül werden infolgedessen abgespalten und reagieren zu einem Ammonium-Ion. Als Produkt entsteht so Benzaldehyd (5).

Verwendet man mehrwertige Phenole oder Phenolether als Ausgangsstoff, so ist kein Katalysator erforderlich.
Varianten
Gattermann-Adams-Reaktion
Bei der Gattermann-Adams-Reaktion[5] handelt es sich ebenfalls um eine Namensreaktion der Organischen Chemie. Während der Reaktion wird aus Zinkcyanid unter Einwirkung von Chlorwasserstoff die Blausäure freigesetzt und kann wie bei der Gattermann-Reaktion umgesetzt werden. Die Aktivität des dabei entstehenden Zink(II)-chlorids reicht aus, um als Katalysator bei der Umsetzung mit reaktionsfähigeren Phenolen zu wirken. Bei der Reaktion mit trägeren Phenolen muss zusätzlich Aluminiumchlorid als Katalysator zugesetzt werden.
Gattermann-Koch-Reaktion
Die Gattermann-Koch-Synthese gehört auch zu den Namensreaktionen der Organischen Chemie, welche nach dem deutschen Chemiker Ludwig Gattermann (1860–1920) und dem deutsch-amerikanischen Chemiker Julius Arnold Koch (1864–1956) benannt wurde.[6] Hierbei reagieren Aromaten mit Kohlenmonoxid und Chlorwasserstoff und den Katalysatoren Aluminiumchlorid oder Kupfer(I)-chlorid zu formylierten Aromaten.
Mechanismus
Bei der Gattermann-Koch-Reaktion handelt es sich, wie bei der Gattermann-Synthese, um eine Elektrophile aromatische Substitution.[7] Die Edukte Kohlenmonoxid, Chlorwasserstoff und der Katalysator Aluminiumchlorid reagieren nach einem möglichen Mechanismus[8] zu einem Acylium-Ion 1, welches der Aromat unter Bildung eines Hexadienyl-Kations 2 angreift. Das Kation 2 wird deprotoniert und so rearomatisiert, wobei unter Abspaltung von Aluminiumchlorid Benzaldehyd (3) entsteht.

Die Gattermann-Koch-Synthese muss unter Ausschluss von Wasser stattfinden. Phenole, Phenolether und Nitrobenzole sind für diese Variante nicht geeignet und gehen dadurch keine Reaktion ein.[1]
Siehe auch
- Becker, Heinz G.O.: Organikum, 22. Auflage, Wiley-VCH, Weinheim, 2004, ISBN 3-527-31148-3.
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie; S. Hirzel Verlag, Stuttgart – Leipzig 1998, 23. überarb. und aktualisierte Auflage; ISBN 3-7776-0808-4.
- Organikum, VEB Deutscher Verlag der Wissenschaften, Berlin 1976.
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, ISBN 3-342-00280-8, S. 355.
- T. Laue, A. PLagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 149–152.
- B. P. Mundy, M. G. Ellert, F. G. Favaloro, Jr.: Name Reactions in Organic Synthesis. 2. Auflage. Wiley & Sons, 2005, ISBN 0-471-22854-0, S. 272–273.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis – Background and Detailed Mechanisms. Elsevier Inc., 2005, ISBN 978-0-12-369483-6, S. 184–185.
- R. Adams, I. Levine: Simplification of the Gattermann Synthesis of Hydroxy Aldehydes. In: J. Am. Chem. Soc. Band 45, 1923, S. 2373–2377, doi:10.1021/ja01663a020.
- Gattermann, L.; Koch, J. A.: Eine Synthese aromatischer Aldehyde. In: Ber. Band 30, 1897, S. 1622, doi:10.1002/cber.18970300288.
- T. Laue, A. PLagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 149–152.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis – Background and Detailed Mechanisms. Elsevier Inc., 2005, ISBN 978-0-12-369483-6, S. 184–185.