Coiled-Coil
Der englische Begriff Coiled-Coil, sinngemäß übersetzt gewundene Schraube oder Doppelwendel, bezeichnet ein Proteinstrukturmotiv. Eine Doppelwendel ist eine Helix, welche ihrerseits wiederum zu einer Helix mit größerem Radius gewunden ist.

Ein Coiled-Coil ist eine stabile, lineare Domäne die aus mindestens zwei Einzelhelices besteht. In der Regel sind dies α-Helices. Diese Einzelhelices sind umeinander zu einer Mehrfachhelix gewunden. Demnach handelt es sich bei jeder einzelnen der verwundenen Einzelhelices um eine Doppelwendel. In den Begriff an sich geht also nicht mit ein, dass ein Coiled-Coil aus mehreren Einzelhelices besteht.
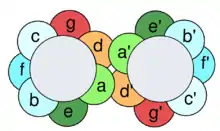
Charakteristisch für Coiled-Coils ist das sogenannte Heptadenmuster, bei dem hydrophobe Aminosäurereste an 1. und 4. Position eines sieben Aminosäuren umfassenden Abschnitts stehen. Durch die hydrophobe Wechselwirkung dieser Aminosäuren wird die Coiled-Coil-Struktur stabilisiert.
Eine der häufigsten Coiled-Coil-Strukturen ist die bZIP-Domäne (auch Leucin-Zipper).
Coiled-Coil-Motive sind in vielen Proteinen zu finden, beispielsweise in Transkriptionsfaktoren oder aber in beim Vesikeltransport beteiligten Proteinen. Vermutlich haben sie weiterhin oft eine Funktion als Abstandhalter. Bei einigen Proteinen tragen sie auch zur Dimer-Bildung bei.
 Leucin-Zipper-Domäne des Transkriptionsfaktors GCN4
Leucin-Zipper-Domäne des Transkriptionsfaktors GCN4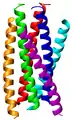 Das gp41-Hexamer, welches das Eindringen von HIV in die Zelle ermöglicht
Das gp41-Hexamer, welches das Eindringen von HIV in die Zelle ermöglicht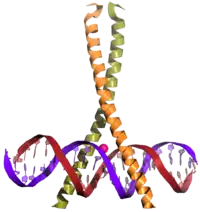 Der Transkriptionsfaktor CREB
Der Transkriptionsfaktor CREB
Proteine mit Coiled-Coil
- Lamin und andere Intermediärfilamente
- Bestimmte Myosine
- Fibrin
Literatur
- Alison K. Gillingham, Sean Munro: Long coiled-coil proteins and membrane traffic. In: Biochimica et Biophysica Acta, Band 1641, Nr. 2/3, 2003, S. 71–85; doi:10.1016/S0167-4889(03)00088-0.
- Y. Bruce Yu: Coiled-coils: stability, specificity, and drug delivery potential. In: Advanced Drug Delivery Reviews, Band 54, Nr. 8, 2002, S. 1113–1129; doi:10.1016/S0169-409X(02)00058-3.
Weblinks
- Datenbank von Arabidopsis thaliana coiled-coil-Proteinen. coiled-coil.org