Favipiravir
Favipiravir (synonym T-705) ist ein Virostatikum, das als Avigan zur oralen Behandlung von Infektionen mit verschiedenen RNA-Viren verwendet wird. Es gehört, wie auch die strukturell verwandten Virostatika T-1105 und T-1106, zu den Pyrazincarboxamiden.[3] Favipiravir wurde während der Ebolafieber-Epidemie 2014 ohne die üblicherweise notwendige Arzneimittelzulassung an Menschen eingesetzt, im Mai 2020 erhielt es als Avifavir in Russland eine Notfallzulassung zur Behandlung von COVID-19.
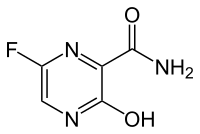
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Favipiravir | |||||||||||||||
| Andere Namen |
6-Fluor-3-hydroxy-2-pyrazincarboxamid | |||||||||||||||
| Summenformel | C5H4FN3O2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 157,1 g·mol−1 | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung und Gewinnung
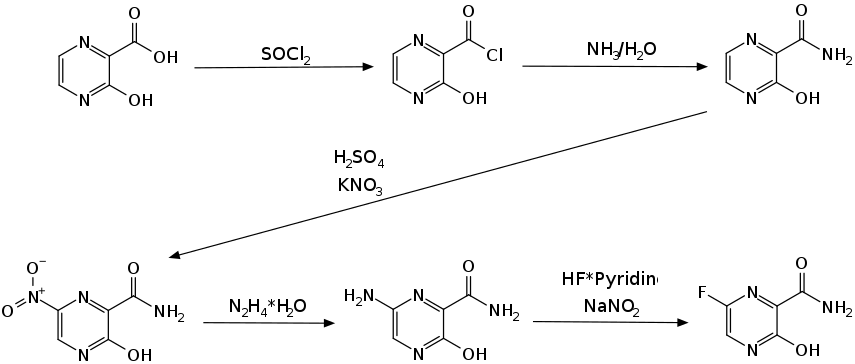
Zur Herstellung von Favipiravir sind verschiedene Synthesewege bekannt.[4][1] Eine Synthesevariante geht von der 3-Hydroxypyrazin-2-carbonsäure aus.[5] Über das Säurechlorid durch Umsetzung mit Thionylchlorid und anschließender Reaktion mit wässrigem Ammoniak wird zunächst das 3-Hydroxypyrazin-2-carbonamid gewonnen. Eine Nitrierung mit Kaliumnitrat und Schwefelsäure ergibt eine Nitrogruppensubstitution in 6-Stellung. Im Folgeschritt wird diese mittels Hydrazinhydrat zum Amin reduziert, welches mittels Natriumnitrit intermediär diazotiert und mit dem Fluorwasserstoff-Pyridin-Komplex zur Zielverbindung umgesetzt wird.
Eigenschaften
Favipiravir ist Guanin-Analogon[6] und ein Inhibitor der viralen RNA-abhängigen RNA-Polymerase von verschiedenen Viren,[7] nicht jedoch von zellulären Polymerasen. Weiterhin erhöht es die Mutationsrate bei der Replikation des Influenzavirus[8] und des Ebolavirus.[9] Favipiravir ist ein Prodrug, das heißt, es wird im Stoffwechsel durch die HGPRT in Favipiravir-ribofuranosyl-5'-monophosphat (FRMP) und Favipiravir-ribofuranosyl-5'-triphosphat (FRTP) überführt,[10][11] wobei FRTP die wirksame Form von Favipiravir bei der Hemmung der RNA-abhängigen RNA-Polymerase ist.[3]
Favipiravir ist unter anderem wirksam gegen das Influenzavirus, das Maul-und-Klauenseuche-Virus, verschiedene Flaviviren (das West-Nil-Virus, das Gelbfieber-Virus), Arenaviren, Bunyaviren und Alphaviren,[3] manche Enteroviren,[12] das Nipahvirus,[13] Noroviren,[14] das Ebolavirus,[15] das Lassa-Virus,[14] das Tollwutvirus[16][17] und das Rifttalfieber-Virus.[18] Es wirkt auch gegen das Zika-Virus, aber schlechter als MK-608.[19]
Therapeutische und experimentelle Verwendung
Favipiravir wurde von Toyama Kagaku Kōgyō entwickelt, einer Tochterfirma der Fujifilm Holdings, und 1999 patentiert. Favipiravir wurde ursprünglich in Japan als Grippemedikament (Handelsname: Avigan) entwickelt, wobei die Arzneimittelzulassung beschränkt wurde auf die Behandlung der Influenza mit neuartigen Virenstämmen, die nicht auf die gängigen Virostatika ansprechen; wegen der in vielen Spezies beobachteten teratogenen (fruchtschädigenden) Wirkung ist es zudem in der Schwangerschaft kontraindiziert.[20] Während der Ebolafieber-Epidemie 2014 bot Japan der WHO an, bei Bedarf Favipiravir zu liefern.[21] Am 4. Oktober 2014 wurde eine französische Krankenschwester der Médecins Sans Frontières mit Favipiravir behandelt und überlebte eine Infektion mit Ebolaviren, die sie sich in Liberia zugezogen hatte.[22] Die Weltgesundheitsorganisation schrieb in einer Stellungnahme, dass es im Zuge der Ebolafieber-Epidemie 2014 ethisch akzeptabel sei, präventive oder therapeutische Arzneimittel ohne Nachweis der Wirksamkeit im Menschen bei ebendiesen einzusetzen, wenn in Tierversuchen vielversprechende Ergebnisse gezeigt werden konnten.[23]
Im Februar 2020 wurde Favipiravir in China in einer ersten nicht randomisierten Doppelblindstudie an 80 Patienten als antivirale Therapie gegen das Coronavirus SARS-CoV-2 getestet.[24][25] In einer weiteren Studie, in der Favipiravir gegen das virostatische Präparat Arbidol (Umifenovir) an jeweils rund 120 Patienten verglichen wurde, zeigte Favipiravir eine signifikante Verbesserung.[26] Rund 71 Prozent der moderat erkrankten Patienten, denen Favipiravir gegeben wurde, hatten sich – teils unter schweren Nebenwirkungen – nach sieben Tagen erholt. Bei dem im Vergleich dazu eingesetzten Arbidol waren es knapp 56 Prozent. In einer kleineren Gruppe von zu Beginn der Therapie schwerkranken Patienten zeigte sich kein deutlicher Unterschied.[27] Die Ergebnisse dieser Studie werden jedoch bezweifelt.[26] Favipiravir hat zuvor im Februar 2020 in China die Zulassung zu klinischen Tests zur Evaluierung der Wirksamkeit bei COVID-19 erhalten.[28]
Avigan (Favipiravir) gehört zu den Arzneimitteln, für die das Bundesministerium für Gesundheit im April 2020 die zentrale Beschaffung zur Behandlung infizierter und schwer erkrankter COVID-19-Patienten in Deutschland eingeleitet hat. Da es sich bei einer Covid-19-Therapie um einen individuellen Heilversuch ohne klinischen Wirksamkeitsnachweis handele, solle der Einsatz vorrangig bei schweren Verlaufsformen patientenindividuell erwogen werden.[29]
Am 29. Mai 2020 genehmigte das russische Gesundheitsministerium eine generische Version von Favipiravir unter dem Medikamentennamen Avifavir zur Behandlung von COVID-19.[30] Die Anwendung des Arzneimittels war als Notfallzulassung zunächst nur in der stationären medizinischen Versorgung möglich. Der Russian Direct Investment Fund (RDIF) unterstützte die Entwicklung von Avifavir und gab an, dass es sich in der ersten Phase klinischer Studien als hochwirksam erwiesen habe.[31] Im September 2020 wurde den Präparaten die reguläre Zulassung erteilt.[32]
Literatur
- E. J. Mifsud, F. G. Hayden, A. C. Hurt: Antivirals targeting the polymerase complex of influenza viruses. In: Antiviral research. Band 169, 09 2019, S. 104545, doi:10.1016/j.antiviral.2019.104545, PMID 31247246.
Weblinks
- Avifavir. Medum.ru. In: Russisches Arzneimittelhandbuch.
- Favipiravir. U.S. National Library of Medicine. In: Drug Information Portal.
Einzelnachweise
- Guo, Qi; Xu, Mingshuo; Guo, Shuang; Zhu, Fuqiang; Xie, Yuanchao; Shen, Jingshan: The complete synthesis of favipiravir from 2-aminopyrazine in Chemical Papers 73 (2019) 1043–1051, doi:10.1007/s11696-018-0654-9.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Y. Furuta, K. Takahashi, K. Shiraki, K. Sakamoto, D. F. Smee, D. L. Barnard, B. B. Gowen, J. G. Julander, J. D. Morrey: T-705 (favipiravir) and related compounds: Novel broad-spectrum inhibitors of RNA viral infections. In: Antiviral Research. Band 82, Nummer 3, Juni 2009, S. 95–102, doi:10.1016/j.antiviral.2009.02.198, PMID 19428599.
- Furuta Y, Takahashi K.: Nitrogenous heterocyclic carboxamide derivatives or salts thereof and antiviral agents containing both, WO 00/10569[P]. 2001-04-07.
- Fangyuan Shi; Zongtao Li; Lingjin Kong; Yuanchao Xie; Tao Zhang; Wenfang Xu: Synthesis and crystal structure of 6-fluoro-3-hydroxypyrazine-2-carboxamide in Drug Discoveries & Therapeutics 8 (2014) 117–120, doi:10.5582/ddt.2014.01028.
- E. De Clercq: New Nucleoside Analogues for the Treatment of Hemorrhagic Fever Virus Infections. In: Chemistry, an Asian journal. Band 14, Nummer 22, November 2019, S. 3962–3968, doi:10.1002/asia.201900841, PMID 31389664.
- Z. Jin, L. K. Smith, V. K. Rajwanshi, B. Kim, J. Deval: The ambiguous base-pairing and high substrate efficiency of T-705 (Favipiravir) Ribofuranosyl 5'-triphosphate towards influenza A virus polymerase. In: PLOS ONE. Band 8, Nummer 7, 2013, S. e68347, doi:10.1371/journal.pone.0068347, PMID 23874596, PMC 3707847 (freier Volltext).
- T. Baranovich, S. S. Wong, J. Armstrong, H. Marjuki, R. J. Webby, R. G. Webster, E. A. Govorkova: T-705 (favipiravir) induces lethal mutagenesis in influenza A H1N1 viruses in vitro. In: Journal of Virology. Band 87, Nummer 7, April 2013, S. 3741–3751, doi:10.1128/JVI.02346-12, PMID 23325689, PMC 3624194 (freier Volltext).
- J. Guedj, G. Piorkowski, F. Jacquot, V. Madelain, T. H. Nguyen, A. Rodallec, S. Gunther, C. Carbonnelle, F. Mentré, H. Raoul, X. de Lamballerie: Antiviral efficacy of favipiravir against Ebola virus: A translational study in cynomolgus macaques. In: PLoS medicine. Band 15, Nummer 3, 03 2018, S. e1002535, doi:10.1371/journal.pmed.1002535, PMID 29584730, PMC 5870946 (freier Volltext).
- D. F. Smee, B. L. Hurst, H. Egawa, K. Takahashi, T. Kadota, Y. Furuta: Intracellular metabolism of favipiravir (T-705) in uninfected and influenza A (H5N1) virus-infected cells. In: The Journal of antimicrobial chemotherapy. Band 64, Nummer 4, Oktober 2009, S. 741–746, doi:10.1093/jac/dkp274, PMID 19643775, PMC 2740635 (freier Volltext).
- L. Naesens, L. W. Guddat, D. T. Keough, A. B. van Kuilenburg, J. Meijer, J. Vande Voorde, J. Balzarini: Role of human hypoxanthine guanine phosphoribosyltransferase in activation of the antiviral agent T-705 (favipiravir). In: Molecular pharmacology. Band 84, Nummer 4, Oktober 2013, S. 615–629, doi:10.1124/mol.113.087247, PMID 23907213.
- Y. Furuta, B. B. Gowen, K. Takahashi, K. Shiraki, D. F. Smee, D. L. Barnard: Favipiravir (T-705), a novel viral RNA polymerase inhibitor. In: Antiviral research. Band 100, Nummer 2, November 2013, S. 446–454, doi:10.1016/j.antiviral.2013.09.015, PMID 24084488, PMC 3880838 (freier Volltext).
- S. Banerjee, N. Gupta, P. Kodan, A. Mittal, Y. Ray, N. Nischal, M. Soneja, A. Biswas, N. Wig: Nipah virus disease: A rare and intractable disease. In: Intractable & rare diseases research. Band 8, Nummer 1, Februar 2019, S. 1–8, doi:10.5582/irdr.2018.01130, PMID 30881850, PMC 6409114 (freier Volltext).
- L. Delang, R. Abdelnabi, J. Neyts: Favipiravir as a potential countermeasure against neglected and emerging RNA viruses. In: Antiviral research. Band 153, 05 2018, S. 85–94, doi:10.1016/j.antiviral.2018.03.003, PMID 29524445.
- S. J. Smither, L. S. Eastaugh, J. A. Steward, M. Nelson, R. P. Lenk, M. S. Lever: Post-exposure efficacy of oral T-705 (Favipiravir) against inhalational Ebola virus infection in a mouse model. In: Antiviral research. Band 104, April 2014, S. 153–155, doi:10.1016/j.antiviral.2014.01.012. PMID 24462697.
- K. Yamada, K. Noguchi, T. Komeno, Y. Furuta, A. Nishizono: Efficacy of Favipiravir (T-705) in Rabies Postexposure Prophylaxis. In: The Journal of Infectious Diseases. Band 213, Nummer 8, April 2016, S. 1253–1261, doi:10.1093/infdis/jiv586, PMID 26655300, PMC 4799667 (freier Volltext).
- J. Murphy, C. D. Sifri, R. Pruitt, M. Hornberger, D. Bonds, J. Blanton, J. Ellison, R. E. Cagnina, K. B. Enfield, M. Shiferaw, C. Gigante, E. Condori, K. Gruszynski, R. M. Wallace: Human Rabies - Virginia, 2017. In: MMWR. Morbidity and mortality weekly report. Band 67, Nummer 5152, Januar 2019, S. 1410–1414, doi:10.15585/mmwr.mm675152a2, PMID 30605446, PMC 6334827 (freier Volltext).
- Caroline AL, Powell DS, Bethel LM, Oury TD, Reed DS, et al. (2014) Broad Spectrum Antiviral Activity of Favipiravir (T-705): Protection from Highly Lethal Inhalational Rift Valley Fever. PLoS Neglected Tropical Diseases 8(4): e2790. doi:10.1371/journal.pntd.0002790.
- N. Mumtaz, J. J. van Kampen, C. B. Reusken, C. A. Boucher, M. P. Koopmans: Zika Virus: Where Is the Treatment? In: Current treatment options in infectious diseases. Band 8, 2016, S. 208–211, doi:10.1007/s40506-016-0083-7, PMID 27547128, PMC 4969322 (freier Volltext).
- F. G. Hayden, N. Shindo: Influenza virus polymerase inhibitors in clinical development. In: Current opinion in infectious diseases. Band 32, Nummer 2, 04 2019, S. 176–186, doi:10.1097/QCO.0000000000000532, PMID 30724789, PMC 6416007 (freier Volltext).
- Ebola outbreak: Japan offers anti-influenza drug for treatment. CBC News Health. 25. August 2014. Abgerufen am 15. Januar 2015.
- French nurse cured of Ebola. RFI. 4. Oktober 2014.
- WHO - Ethical considerations for use of unregistered interventions for Ebola virus disease. Abgerufen am 8. Oktober 2014.
- L. Dong, S. Hu, J. Gao: Discovering drugs to treat coronavirus disease 2019 (COVID-19). In: Drug discoveries & therapeutics. Band 14, Nummer 1, 2020, S. 58–60, doi:10.5582/ddt.2020.01012, PMID 32147628.
- Wang Xiaoyu: Drugs with potential against coronavirus in human trials. In: Website China Daily. 15. Februar 2020, abgerufen am 17. Februar 2020 (englisch).
- Anja Martini, Christian Drosten: Coronavirus-Update. (PDF) Folge 22. In: ndr.de. Norddeutscher Rundfunk, 26. März 2020, S. 6 f., abgerufen am 27. März 2020.
- Kazuhiro Nogi: Was kann das Grippemittel Avigan, das die Bundesregierung kauft? In: spiegel.de. 2. April 2020, abgerufen am 2. April 2020.
- Zhang Yangfei: First antiviral drug approved to fight coronavirus. In: Website China Daily. 17. Februar 2020, abgerufen am 17. Februar 2020 (englisch).
- Informationen der Institutionen und Behörden: BMG: Zentrale Beschaffung von Arzneimitteln zur Therapie schwerwiegender Verläufe COVID-19 infizierter Patienten und Verteilung an Apotheken durch die Bundeswehr, Arzneimittelkommission der Deutschen Apotheker (AMK), Nachrichten vom 24. März 2020.
- Avifavir Included in the List of Nationally Recommended Drugs for Treatment of COVID-19. In: www.gmpnews.net. 6. Juni 2020, abgerufen am 16. Juni 2020.
- RDIF and ChemRar deliver first batch of Avifavir antiviral drug to Russian hospitals. In: www.pharmiweb.com. 12. Juni 2020, abgerufen am 16. Juni 2020.
- http://grls.rosminzdrav.ru/ abgerufen am 27. September 2020.