Expressionsvektor
Ein Expressionsvektor ist eine Nukleinsäure, die zur Herstellung rekombinanter Proteine durch Überexpression verwendet wird. Expressionsvektoren gehören zu den Vektoren. Im Gegensatz zu Expressionsvektoren sind Klonierungsvektoren nicht für die Expression von Proteinen geeignet, sondern nur zur Klonierung.
Eigenschaften
Expressionsvektoren besitzen ein Operon, damit in einem geeigneten Wirt als Expressionssystem oder durch eine zellfreie Genexpression[1][2][3] eine mRNA mit einer proteincodierenden Sequenz erzeugt wird. Aus der mRNA wird im Zuge der Translation ein Protein erzeugt. Darüber hinaus besitzen Expressionsvektoren einen Replikationsursprung für die Replikation der DNA, eine Sequenz zur Selektion des Expressionsvektors (z. B. eine Antibiotikumresistenz, eine Inaktivierung eines toxischen Gens oder eine Auxotrophie) und einen Polylinker, in die die proteincodierende Sequenz des gewünschten Proteins (das Insert) eingefügt wird.[4] Wenn das zu exprimierende Protein selbst für das Expressionssystem toxisch ist, werden induzierbare Promotoren verwendet, die ein Heranwachsen des Wirts bis zur Induktion ermöglicht. Meistens wird die DNA in Form eines Plasmids verwendet. Oftmals wird zusätzlich eine codierende Sequenz für ein Protein-Tag an die proteincodierende Sequenz angefügt, wodurch ein Fusionsprotein entsteht, das sich leichter reinigen und nachweisen lässt. Expressionsvektoren werden oftmals zusätzlich durch Methoden des Vektordesigns verändert.
Es können in einem Wirt auch mehrere Proteine parallel erzeugt werden, sofern Plasmide mit unterschiedlichen Selektionsmechanismen verwendet werden, da bei gleichem Selektionsmechanismus nur eines notwendig ist und oftmals auch nur ein Typ vom Wirt behalten wird. Ebenso werden Vektoren mit zwei Promotoren eingesetzt.[5] Bei Bakterien können auch Konstrukte mit zwei Cistrons eingesetzt werden.[6] Bei Eukaryoten können mit einer IRES zwischen zwei proteincodierenden Sequenzen zwei verschiedene Proteine parallel erzeugt werden,[7] wobei die Ausbeute des Proteins mit der proteincodierenden Sequenz nach der IRES meist geringer ist.
Bakterielle Expressionsvektoren
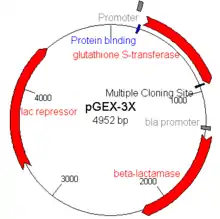
Die kostengünstigste Form der Proteinexpression erfolgt in Einzellern. Allerdings können nicht alle eukaryotischen Proteine durch Bakterien in ihrem nativen Zustand erzeugt werden, wodurch die biologische Aktivität herabgesetzt wird oder unerwünschte Einschlusskörperchen entstehen können, die sich negativ auf die Ausbeute bei der Proteinreinigung auswirken. Als Wirte werden meist Escherichia coli,[8] Bacillus subtilis oder seltener auch Ralstonia eutropha[9] eingesetzt. Neben Plasmiden werden auch Bacterial Artificial Chromosomes verwendet.
Bakterielle Expressionsvektoren besitzen oftmals einen Promotor, der aus dem lac-Operon (dann meist die lacUV5-Mutante ohne Katabolitrepression)[10] oder aus dem Bakteriophagen T7 (z. B. der pET-Vektor) stammen.[11][12] Plasmide des Typs pQE verwenden einen T5-Promotor mit einer geringeren Basalexpression, die sich besser für wirtstoxische Proteine eignen.[13] Weiterhin werden Teile des Arabinose-sensitiven Promotors araBAD oder des Rhamnose-sensitiven Promotors rhaBAD zur Steuerung der Induktion der Genexpression verwendet.[14] Ebenso werden aus verschiedenen Ursprüngen zusammengesetzte Promotoren verwendet, wie der Tac-Promotor aus dem trp- und dem lac-Promotor,[15] beispielsweise beim pGex-Vektor. Als Replikationsursprung von Plasmiden werden meistens solche mit hoher Plasmidkopienzahl verwendet. Eine hohe Plasmidkopienzahl führt zu hoher Genexpression,[16] allerdings auch zu höherer Toxizität toxischer Proteine.[17]
Sofern das zu exprimierende Protein Disulfidbrücken aufweist, ist eine Signalsequenz zur Sekretion ins Periplasma erforderlich, weil das Cytosol reduzierend wirkt und eine Ausbildung von Disulfidbrücken verhindert. Dabei wird meistens eine Protease-Schnittstelle zwischen Signalsequenz und gewünschtem Protein eingefügt, wodurch die Signalsequenz nach oder während der Reinigung des Proteins abgespalten wird, um ein möglichst natives Protein zu erhalten.
Eukaryotische Expressionsvektoren
Die kostengünstigste Expression in Eukaryoten wird in Hefen durchgeführt wie Saccharomyces cerevisiae oder Komagataella phaffii[18] (früher als Pichia pastoris bezeichnet, als Vektor z. B. pIC), die eine Glykosylierung der Proteine durchführen können. Sofern menschenähnlichere Glykosylierungsmuster erforderlich sind, wird eine Überexpression in Insektenzellkultur mit Baculovirus-Vektoren[19] oder in Säuger-Zellkulturen durchgeführt.[20] Als Vektoren werden Plasmide,[21] Yeast Artificial Chromosomes (in Hefen),[22] Mammalian Artificial Chromosomes (in Säugerzellen)[23] oder virale Vektoren verwendet.[24] Plasmide zur Verwendung in Eukaryoten besitzen zwar ein eukaryotisches Operon, aber zur kostengünstigen Vermehrung in Bakterien einen bakteriellen Replikationsursprung. Aufgrund fehlender eukaryotischer Replikationsursprünge werden Plasmide in Eukaryoten nicht repliziert, wodurch die Dauer der Expression des Protein wegen des Abbaus der Plasmide begrenzt ist (transiente Expression).
In Säugerzellen wird oftmals ein CMV-immediate/early-1-Promotor oder ein SV40-Promotor verwendet, seltener auch ein EF-1-Promotor[25] oder der Hühner-β-Aktin-Promotor sowie Hybride aus mehreren Promotoren.[26][27][28] Nachfolgend auf die proteincodierende Sequenz wird eine Poly-A-Sequenz (z. B. aus dem Gen des Rinder-Somatotropins bGH oder aus dem SV40-Virus) verwendet, wodurch der Abbau der mRNA verlangsamt wird.
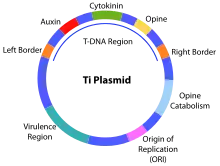
In Pflanzen wird oftmals das Ti-Plasmid verwendet,[29] oder ein viraler Vektor basierend auf dem Tabakmosaikvirus (TMV), dem Potato-Virus X oder dem Cowpea-Mosaic-Virus.[30][31]
Verwendung
Expressionsvektoren werden zur Produktion von rekombinanten Proteinen eingesetzt, in der biochemischen Forschung oder im biotechnologisch-industriellen Produktion von Proteinen. Ebenso werden sie verwendet, um dauerhaft transgene Organismen zu erzeugen, beim Menschen zur Gentherapie.
Literatur
- O. Gileadi: Recombinant Protein Expression in E. coli : A Historical Perspective. In: Methods in molecular biology. Band 1586, 2017, S. 3–10, doi:10.1007/978-1-4939-6887-9_1, PMID 28470595.
Einzelnachweise
- T. Terada, T. Murata, M. Shirouzu, S. Yokoyama: Cell-free expression of protein complexes for structural biology. In: Methods in molecular biology. Band 1091, 2014, S. 151–159, doi:10.1007/978-1-62703-691-7_10, PMID 24203330.
- A. K. Brödel, D. A. Wüstenhagen, S. Kubick: Cell-free protein synthesis systems derived from cultured mammalian cells. In: Methods in molecular biology. Band 1261, 2015, S. 129–140, doi:10.1007/978-1-4939-2230-7_7, PMID 25502197.
- Dmitriy A. Vinarov, Carrie L. Loushin Newman, Ejan M. Tyler, John L. Markley, Mark N. Shahan: Wheat Germ Cell‐Free Expression System for Protein Production. In: Current Protocols in Protein Science (2006). Band 44, Ausgabe 1, S. 5.18.1-5.18.18. doi:10.1002/0471140864.ps0518s44.
- Mary Campbell: Biochemistry. Cengage Learning, 2007, ISBN 978-0-495-39041-1, S. 378.
- S. Öztürk, B. G. Ergün, P. Çalık: Double promoter expression systems for recombinant protein production by industrial microorganisms. In: Applied Microbiology and Biotechnology. Band 101, Nummer 20, Oktober 2017, S. 7459–7475, doi:10.1007/s00253-017-8487-y, PMID 28900685.
- B. E. Schoner, R. M. Belagaje, R. G. Schoner: Translation of a synthetic two-cistron mRNA in Escherichia coli. In: Proceedings of the National Academy of Sciences. Band 83, Nummer 22, November 1986, S. 8506–8510, PMID 3534891, PMC 386959 (freier Volltext).
- I. M. Terenin, V. V. Smirnova, D. E. Andreev, S. E. Dmitriev, I. N. Shatsky: A researcher's guide to the galaxy of IRESs. In: Cellular and molecular life sciences : CMLS. Band 74, Nummer 8, 04 2017, S. 1431–1455, doi:10.1007/s00018-016-2409-5, PMID 27853833.
- G. J. Gopal, A. Kumar: Strategies for the production of recombinant protein in Escherichia coli. In: The protein journal. Band 32, Nummer 6, August 2013, S. 419–425, doi:10.1007/s10930-013-9502-5, PMID 23897421.
- S. Gruber, D. Schwendenwein, Z. Magomedova, E. Thaler, J. Hagen, H. Schwab, P. Heidinger: Design of inducible expression vectors for improved protein production in Ralstonia eutropha H16 derived host strains. In: Journal of biotechnology. Band 235, Oktober 2016, S. 92–99, doi:10.1016/j.jbiotec.2016.04.026, PMID 27085887.
- A. E. Silverstone, R. R. Arditti, B. Magasanik: Catabolite-insensitive revertants of lac promoter mutants. In: Proceedings of the National Academy of Sciences. Band 66, Nummer 3, Juli 1970, S. 773–779, PMID 4913210, PMC 283117 (freier Volltext).
- J. W. Dubendorff, F. W. Studier: Controlling basal expression in an inducible T7 expression system by blocking the target T7 promoter with lac repressor. In: Journal of molecular biology. Band 219, Nummer 1, Mai 1991, S. 45–59, PMID 1902522.
- J. C. Samuelson: Recent developments in difficult protein expression: a guide to E. coli strains, promoters, and relevant host mutations. In: Methods Mol Biol. (2011), Bd. 705, S. 195–209. PMID 21125387.
- J. Konczal, C. H. Gray: Streamlining workflow and automation to accelerate laboratory scale protein production. In: Protein expression and purification. Band 133, Mai 2017, S. 160–169, doi:10.1016/j.pep.2017.03.016, PMID 28330825.
- L. Marschall, P. Sagmeister, C. Herwig: Tunable recombinant protein expression in E. coli: promoter systems and genetic constraints. In: Applied Microbiology and Biotechnology. Band 101, Nummer 2, Januar 2017, S. 501–512, doi:10.1007/s00253-016-8045-z, PMID 27999902, PMC 5566544 (freier Volltext).
- H. A. de Boer, L. J. Comstock, M. Vasser: The tac promoter: a functional hybrid derived from the trp and lac promoters. In: Proceedings of the National Academy of Sciences. Band 80, Nummer 1, Januar 1983, S. 21–25, PMID 6337371, PMC 393301 (freier Volltext).
- C. French, J. M. Ward: Production and modification of E. coli transketolase for large-scale biocatalysis. In: Annals of the New York Academy of Sciences. Band 799, Oktober 1996, S. 11–18, PMID 8958067.
- M. P. Mayer: A new set of useful cloning and expression vectors derived from pBlueScript. In: Gene. Band 163, Nummer 1, September 1995, S. 41–46, PMID 7557476.
- J. M. Cregg, J. L. Cereghino, J. Shi, D. R. Higgins: Recombinant protein expression in Pichia pastoris. In: Molecular biotechnology. Band 16, Nummer 1, September 2000, S. 23–52, doi:10.1385/MB:16:1:23, PMID 11098467.
- R. D. Possee, L. A. King: Baculovirus Transfer Vectors. In: Methods in molecular biology. Band 1350, 2016, S. 51–71, doi:10.1007/978-1-4939-3043-2_3, PMID 26820853.
- 24312845.
- K. H. Khan: Gene expression in Mammalian cells and its applications. In: Advanced pharmaceutical bulletin. Band 3, Nummer 2, 2013, S. 257–263, doi:10.5681/apb.2013.042, PMID 24312845, PMC 3848218 (freier Volltext).
- Andrew W. Murray, Jack W. Szostak: Construction of artificial chromosomes in yeast. In: Nature. 305, 1983, S. 189, doi:10.1038/305189a0.
- A. Martella, S. M. Pollard, J. Dai, Y. Cai: Mammalian Synthetic Biology: Time for Big MACs. In: ACS synthetic biology. Band 5, Nummer 10, 10 2016, S. 1040–1049, doi:10.1021/acssynbio.6b00074, PMID 27076218.
- K. L. Hefferon: Virus expression vectors. In: Pharmaceutical patent analyst. Band 3, Nummer 3, Mai 2014, S. 249–260, doi:10.4155/ppa.14.17, PMID 24998286.
- D. W. Kim, T. Uetsuki, Y. Kaziro, N. Yamaguchi, S. Sugano: Use of the human elongation factor 1 alpha promoter as a versatile and efficient expression system. In: Gene. Band 91, Nummer 2, Juli 1990, S. 217–223, PMID 2210382.
- L. Xu, H. Mizuguchi, A. Ishii-Watabe, E. Uchida, T. Mayumi, T. Hayakawa: Optimization of transcriptional regulatory elements for constructing plasmid vectors. In: Gene. Band 272, Nummer 1–2, Juli 2001, S. 149–156, PMID 11470520.
- J. Y. Qin, L. Zhang, K. L. Clift, I. Hulur, A. P. Xiang, B. Z. Ren, B. T. Lahn: Systematic comparison of constitutive promoters and the doxycycline-inducible promoter. In: PLOS ONE (2010), Bd. 5(5), S. e10611. PMID 20485554; PMC 2868906 (freier Volltext).
- J. Blazeck, H. S. Alper: Promoter engineering: Recent advances in controlling transcription at the most fundamental level. In: Biotechnol J. (2012), doi:10.1002/biot.201200120. PMID 22890821.
- R. Walden, J. Schell: Techniques in plant molecular biology–progress and problems. In: European Journal of Biochemistry. Band 192, Nummer 3, September 1990, S. 563–576, PMID 2209611.
- M. C. Cañizares, L. Nicholson, G. P. Lomonossoff: Use of viral vectors for vaccine production in plants. In: Immunology and cell biology. Band 83, Nummer 3, Juni 2005, S. 263–270, doi:10.1111/j.1440-1711.2005.01339.x, PMID 15877604.
- K. Hefferon: Plant Virus Expression Vectors: A Powerhouse for Global Health. In: Biomedicines. Band 5, Nummer 3, Juli 2017, S. , doi:10.3390/biomedicines5030044, PMID 28758953, PMC 5618302 (freier Volltext).