Nativer Zustand
Der native Zustand (synonym native Konformation) ist in der Biochemie eine Konformation von Biopolymeren mit der niedrigsten freien Energie. Die Aufhebung des nativen Zustands wird als Denaturierung bezeichnet.
Eigenschaften
Manche Biopolymere wie Proteine und Nukleinsäuren besitzen eine bevorzugte Konformation niedrigster Energie. Die günstigste Konformation ist nach dem Prinzip des kleinsten Zwangs abhängig von den jeweiligen Umgebungsbedingungen. Für nichtsezernierte Biopolymere liegt der native Zustand unter den physiologischen Bedingungen innerhalb einer Zelle vor. Der native Zustand eines gereinigten Biopolymers kann mit der NMR-Spektroskopie unter nativen Bedingungen bestimmt werden.
Proteine
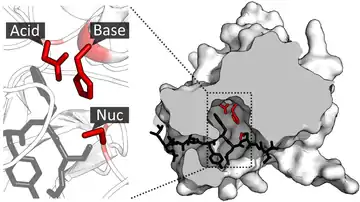
Bei Proteinen ist der native Zustand die Proteinfaltung, die sich (teilweise mit Hilfe von Chaperonen) selbstständig ausbildet. Bei metastabilen Proteinen ist die native Faltung nicht unbedingt die Konformation niedrigster freier Energie.[1] Die korrekte Faltung ist für die Erfüllung der Funktionen des Proteins notwendig, z. B. Protein-Protein-Interaktionen, Protein-DNA-Interaktionen, Protein-RNA-Interaktionen oder Protein-Lipid-Interaktionen und bei Enzymen zusätzlich noch für die Enzymaktivität des katalytischen Zentrums. Falsch gefaltete Proteine werden durch die Proteinqualitätskontrolle erkannt. Die Energien verschiedener Proteinfaltungen werden in Anlehnung an das Anfinsen-Dogma als Faltungstrichter dargestellt. Das Levinthal-Paradox liefert einen Hinweis, dass bei der Faltung eines Proteins nicht alle möglichen Konformationen ausprobiert werden, sondern dass eine kumulative Selektion einzelner, teilweise parallel verlaufender Faltungsschritte erfolgt.[2] Die typischen Winkel bei der Drehung zweier Aminosäuren gegeneinander (Diederwinkel) werden in einem Ramachandran-Plot oder Janin-Plot dargestellt. Bei Proteinen mit einer Molten-Globule-Form, metamorphen Proteinen oder im Extremfall bei intrinsisch unstrukturierten Proteinen sind die Diederwinkel nicht fest, sondern besitzen eine Spannweite erlaubter Winkelgrade und somit erlaubter Konformationen.
Nukleinsäuren
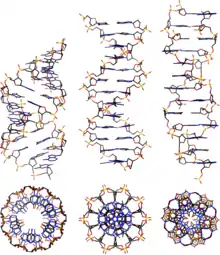
Zwei zueinander komplementäre Stränge von Nukleinsäuren wie DNA oder RNA bilden aufgrund der Basenpaarung und der Basenstapelung eine der Doppelhelix-Strukturen, je nach Umgebungsbedingung in Form von A-DNA, B-DNA oder Z-DNA. Die in Zellen hauptsächlich vorliegende Form ist B-DNA.
Kohlenhydrate
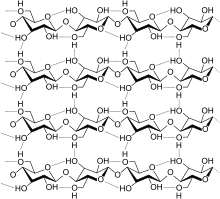
Manche Polysaccharide besitzen ebenfalls eine bevorzugte Struktur. Cellulose ist im nativen Zustand wasserunlöslich.[3] Cellulose wird bei der Herstellung von Viskose oder Cupro denaturiert und vorübergehend wasserlöslich. Nach der Fasererzeugung wird die Rückführung in die Unlöslichkeit durch eine reversible Reaktion (Viskose) oder Verdünnung des Denaturierungsmittels (Cupro) erreicht.
Einzelnachweise
- S. Govindarajan, R. A. Goldstein: On the thermodynamic hypothesis of protein folding. In: Proceedings of the National Academy of Sciences. Band 95, Nummer 10, Mai 1998, S. 5545–5549, PMID 9576919, PMC 20414 (freier Volltext).
- Jeremy M. Berg: Stryer Biochemie. Springer-Verlag, 2017, ISBN 978-3-662-54620-8, S. 64.
- Tanja Wüstenberg: Cellulose und Cellulosederivate. Behr's Verlag DE, 2013, ISBN 978-3-954-68188-4, S. 15.