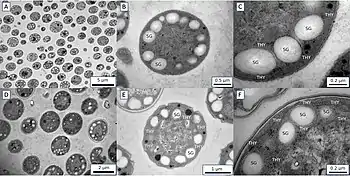
Crocosphaera
Crocosphaera ist eine Gattung von Cyanobakterien in der Familie Aphanothecaceae. Typusspezies ist Crocosphaera watsonii mit Referenzstamm WH8501.[4]
| Crocosphaera | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
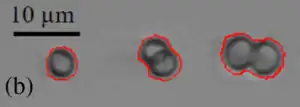
Crocosphaera, Einzel- und Dublett-Zellen, | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Crocosphaera | ||||||||||||
| Zehr, Rachel A.Foster, Waterbury & E.Webb 2019[2] |

C. watsonii ist eine Art (Spezies) einzelliger, diazotropher mariner Cyanobakterien mit ca. 2,5–6 µm Durchmesser, die weniger als 0,1 % der marinen mikrobiellen Population ausmachen.[5] Sie gedeihen in oligotrophen küstennahen Regionen des offenen Ozeans (d. h. im Offshore-Bereich, vgl. Offshore-Bauwerke), wo das Wasser wärmer als 24 °C ist..[6] Die Zelldichte von C. watsonii kann in der euphotischen Zone 1000 Zellen pro Milliliter überschreiten; ihr Wachstum kann jedoch durch die Phosphorkonzentration begrenzt sein.[7][8] Aufgrund der Größe, der Häufigkeit und der schnellen Wachstumsrate können diese Einzeller merklich zum ozeanischen Kohlenstoff- und Stickstoffhaushalt in tropischen Ozeanen beitragen.[7] Sie sind Stickstofffixierer, die während der Nacht atmosphärischen Stickstoff (N2) zu Ammoniak (NH3) fixieren und so zu neuem Stickstoff in den Ozeanen beitragen.[9] Sie sind daher eine wichtige Stickstoffquelle für Ökosysteme in offenen Ozeanen.[10] Die Stickstofffixierung in den Ozeanen ist wichtig, weil sie das Wachstum des Phytoplanktons ermöglicht, wenn Stickstoff und Ammonium sehr knapp sind. Es werden auch weitere Formen von Stickstoff wieder aufgefüllt, wodurch der Ozean insgesamt gedüngt wird und weiteres Phytoplanktonwachstum ermöglicht wird.[10]
Beschreibung
Die Typusspezies C. watsonii wurde hinsichtlich verschiedener Aspekte stellvertretend für die Gattung genauer untersucht. Die folgenden Aspekte sind von besonderem Interesse:
Tagesgang
Diazotrophe Cyanobakterien haben eine Reihe von Mechanismen entwickelt, die sicherstellen, dass der für die Stickstofffixierung verantwortliche sauerstoffempfindliche Enzymkomplex nicht durch Sauerstoff gestört wird.[11] Sauerstoff (O2) ist besonders giftig für das zur Stickstofffixierung benötigte Enzym Nitrogenase.
Eine Möglichkeit, wie stickstofffixierende Cyanobakterien (z. B. der Gattungen Nostoc und Anabaena), die Sauerstofftoxizität vermeiden, sind Zellverbände mit spezialisierten Zellen (Heterocysten alias Heterozyten), denen das Photosystem II fehlt und die daher keinen Sauerstoff produzieren.[12] Bei diesen kolonienbildenden Vertretern besteht also eine „räumliche“ Trennung der beiden Prozesse infolge Zelldifferenzierung.
Als Einzeller geht C. watsonii einen anderen Weg, der in der Anpassung an den Tagesrhythmus (Tagesgang, englisch diel rhythm, diurnal cycle, diel cycle) besteht.[11][13][14][15] Dadurch wird der Kohlenstoff- und Stickstoff-Metabolismus „zeitlich“ zwischen Tag und Nacht getrennt.[11][15][14][13] Da eine Reihe von Enzymen an der Regulation des Kohlenstoff- und Stickstoff-Stoffwechsels beteiligt sind, macht diese Trennung eine zeitliche Regulierung vieler Enzyme und Prozesse in diesen Bakterien nötig. Tatsächlich zeigen viele an der Stickstofffixierung und der Photosynthese beteiligte Gene in der Transkription (d. h. ihrer Aktivität) eine Variation zwischen Tag und Nacht. Dieser Unterschied in der Genexpression zwischen Licht- und Dunkelperioden ist dabei für Gene, die an der Stickstofffixierung beteiligt sind, etwa zehnmal größer als für Gene, die an der Photosynthese beteiligt sind. Offenbar sind bei diesen Cyanobakterien die Photosysteme im Vergleich zur Nitrogenase deutlich stabiler.[11]
Es wurden bis heute bereits viele dieser an der Stickstofffixierung und der Photosynthese beteiligten Gene hinsichtlich ihrer Expression individuell überwacht. Dazu gehören Gene, die für die Proteine nifH, nifX, ntcA, glgP, die Glutamat-Synthetase und glnB-ähnliche Proteine kodieren – sie alle spielen eine wesentliche Rolle bei der Stickstofffixierung. Die Expression dieser Gene war zu Beginn der Dunkelperiode am höchsten und in der frühen Lichtperiode am niedrigsten.[11]
Darüber hinaus zeigten Gene, die für photosynthetische Proteine wie Photosystem-I-Untereinheit VII (psaC), das Photosystem-II-Protein D1 (psbA1) und das Photosystem-II-Protein psbO, sowie glgA kodieren einen Tagesgang in der Expression. Sie hatten die höchste und niedrigste Expression zur Tages- bzw. Nachtzeit.[11]
Insgesamt zeigte etwa 30 % des Genoms von C. watsonii einen Tagesgang in der Expression. Alle diese Muster weisen auf eine zeitliche Trennung von Photosynthese und Stickstofffixierung in C. watsonii hin.[11]
Blockierung des Photosystems II
Eine weitere Methode, mit der C. watsonii seine stickstofffixierenden Enzymkomplexe schützt, ist die Fähigkeit, das Photosystem II abzuschalten. Dies wurde bis dato (2016) nur bei dieser Art beobachtet.[16] Wenn Kulturen von C. watsonii wechselnden Lichtverhältnissen ausgesetzt werden, wird der die Stickstofffixierung regulierende Hell-Dunkel-Zyklus gestört. Da diazotrophe Organismen aber in der Lage sind, Stickstoff in Gegenwart von Licht zu fixieren, insbesondere während der Zeiten des Übergangs von Licht- zu Dunkelperioden, muss es andere Methoden geben, mit denen sie sich in Gegenwart von Sauerstoff schützen. C. watsonii kann zu diesem Zweck die Sauerstoffentwicklung auf verschiedene Weise stark einschränken:
Diese Spezies hat die Fähigkeit, die Mechanismen des Photosystems II in dunklen Perioden abzuschalten, indem sie die Menge an eigenem Plastochinon (PQ) reduziert. Plastochinon ist ein essentielles Protein im Elektronentransfersystem des Photosystems II. Durch die Begrenzung der verfügbaren Plastochinonmenge wird daher das Photosystem II im praktisch abgeschaltet. Die Zelle erreicht dies, indem sie den Redox-Zustand von Plastochinon in der Dunkelheit verändert.[16]
C. watsonii verlangsamt auch seine Elektronentransferrate bei nahender Dunkelperiode, und die Zelle stellt sich selbst um, um ihr Photosystem abzuschalten. Die Phycobilisomen (Lichtsammelkomplexe für das Photosystem II) lagern sich während der Nachtperiode an das Photosystem I an, was eine weitere Schutzschicht für die stickstofffixierende Maschinerie darstellt.[16]
Eine weitere von C. watsonii benutzte Methode zur vorübergehenden Abschaltung des Photosystems II ist die Deaktivierung des D1-Proteins. Das D1-Protein bildet das Reaktionszentrum des Photosystems II und ist wichtig, da es Chlorophyll bindet.[17]
Die Regulierung des Photosystems II in C. watsonii ist ein schneller Prozess, es kann bei Bedarf sofort inaktiviert oder aktiviert werden. Das Recycling der gleichen Eisenmoleküle sowohl in der Photosynthese als auch in der Stickstofffixierung hilft auch dabei, den Tagesgang von Photosynthese und Stickstofffixierung zu erzwingen.[16][17]
Eisen-Haushalt
Das Gedeihen von Crocosphaera watsonii ist wie auch bei anderen marinen Diazotrophen durch Eisen limitiert.[18][19][20][21][18][22][23][24][25] Der Grund dafür ist, dass die Nitrogenase als das für die Stickstofffixierung in Diazotrophen verantwortliche Enzym Eisen als Cofaktor verwendet.[18][26][9]
Um besser mit Eisenknappheit zurechtzukommen, hat C. watsonii einen spezifischen Mechanismus zur Reduktion der Metalloenzymbestände entwickelt. Die Metalloenzyme werden nämlich nur dann synthetisiert, wenn sie benötigt werden, aber auch wieder abgebaut, sobald sie nicht mehr benötigt werden. Das zugehörige Eisen wird dabei recycelt. Auf diese Weise wird weniger unnötige Eisen für Metalloenzym verbraucht, wenn dieses inaktiv ist. Das frei gewordene Eisen kann dann in anderen Prozessen wie der Stickstofffixierung (d. h.) durch die Nitrogenase verwendet werden. Dieser Mechanismus reduziert den Eisenbedarf von C. watsonii um bis zu 75 %. Er kostet aber natürlich Energie, die jedoch durch energiereiche Kohlenstoffmoleküle bereitgestellt werden kann, die während der Lichtperiode über die Photosynthese produziert wurden.[18]
Phosphor-Haushalt
Eine weitere Beschränkung, der C. watsonii begegnet, ist eine Limitierung von Phosphor. Da C. watsonii in oligotrophen Gewässern lebt, kann sein Wachstum und Gedeihen durch eine Vielzahl von Nährstoffen limitiert werden, unter anderem durch gelöstes anorganisches Phosphat.[27][8] Phosphat wird für viele zelluläre Prozesse benötigt, unter anderem für die Photosynthese, bei der es ein integraler Bestandteil der Maschinerie ist.[8] Phosphor ist ebenso eine wichtige Voraussetzung für die Stickstofffixierung.[7] C. watsonii zeigt eine Abnahme der photosynthetischen Effizienz, wenn Phosphor knapp wird. Im Gegensatz zu den meisten Cyanobakterien reguliert C. watsonii aber seine Phosphatnutzung und seinen Stoffwechsel bei niedrigen Phosphatbedingungen innerhalb der Zelle nicht herunter.[28] Stattdessen benutzt C. watsonii das Protein pstS, das eine hohe Affinität zur Bindung von Phosphor hat, was eine effizientere Aufnahme zu ermöglicht.[7][28] Entsprechend zeigt C. watsonii bei Phosphorknappheit eine erhöhte Transkription von pstS.[27][27][28][5]
Eine weitere Methode zur Messung von Phosphorstress in C. watsonii ist die Betrachtung der Arsenkonzentration innerhalb der Zelle.[27] Wenn Phosphor begrenzt ist, wird „ungewollt“ auch das chemisch ähnliche Arsen innerhalb der Zelle angereichert. Als Reaktion darauf reguliert C. watsonii die Konzentration des Proteins arsB hoch, wodurch das überschüssige Arsen aus der Zelle entfernt wird[11] (Entgiftung).
Diese beiden Faktoren zusammengenommen können daher den Zustand der Zellen in einer bestimmten C. watsonii-Population anzeigen.[27]
Spezies
Systematik nach AlgaeBase[29] und NCBI:[2]
Gattung Crocosphaera Zehr, Rachel A.Foster, Waterbury & E.Webb 2019 (synonym: Erythrosphaera Waterbury et al. 1988)[2]
- Spezies Crocosphaera chwakensis Mareš & J. R. Johansen
- Stamm C. chwakensis CCY0110 – Referenzstamm
- Spezies Crocosphaera subtropica Mareš & J. R. Johansen (früher: Cyanothece sp. ATCC 51142 alias Cyanothece sp. ATCC 51.142)[3] — das Genom zeigt Homologien zu dem der sog. Sphäroidkörper in den Kieselalgen der Familie Rhopalodiaceae.[30]
- Stamm C. subtropica ATCC 51142 – Referenzstamm, ehemals Crocosphaera subtropica ATCC 51142
- Stamm C. subtropica ATCC 51472
- Stamm C. subtropica UCYN-C — nicht bei NCBI, „nahe verwandt mit Cyanothece sp. ATCC 51142“[31]
- Spezies Crocosphaera watsonii Zehr, Rachel A. Foster, Waterbury & E. Webb – Typus
- Stamm C. watsonii WH 0001
- Stamm C. watsonii WH 0002
- Stamm C. watsonii WH 0003
- Stamm C. watsonii WH 0004
- Stamm C. watsonii WH 0005
- Stamm C. watsonii WH 0006
- Stamm C. watsonii WH 0201
- Stamm C. watsonii WH 0401
- Stamm C. watsonii WH 0402
- Stamm C. watsonii WH 8501 – Referenzstamm
- Stamm C. watsonii WH 8502
- Stamm C. watsonii WH 8504
- Stamm C. watsonii WH 8504
- Stamm C. watsonii UCYN-B[32][33][31] – nicht bei NCBI, identisch mit Referenzstamm WH 8501?
- Sonderform[34] Crocosphaera symbiont of Climacodium frauenfeldianum (Coscinodiscophyceae)
Räuber
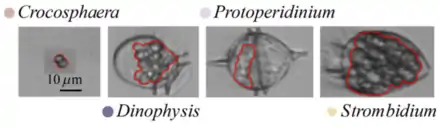
Crocosphaera ist Beute u. a. folgender Räuber:[1]
- Dinophysis (Dinoflagellata)
- Protoperidinium (Dinoflagellata)
- Strombidium (Ciliophora)
Symbiosen

Crocosphaera-Spezies findet man auch als Symbionten in den Schalen von Kieselalgen der Gattung Climacodium.[31]
Einzelnachweise
- Mathilde Dugenne, Fernanda Henderikx Freitas, Samuel T. Wilson, David M. Karl, Angelicque E. White: Life and death of Crocosphaera sp. in the Pacific Ocean: Fine scale predator–prey dynamics, in: Limnol. Oceanogr. 65, 29. Juni 2020, S. 2603–2617, doi:10.1002/lno.11473
- NCBI: Crocosphaera Zehr, Rachel A.Foster, Waterbury et E.Webb 2019 (genus), graphisch: Crocosphaera, auf: Lifemap, NCBI Version
- NCBI: Cyanothece (genus)
- Jan Mareš, Jeffrey R. Johansen, Tomáš Hauer, Jan Zima, Stefano Ventura, Oana Cuzman, Bruno Tiribilli, Jan Kaštovský: Taxonomic resolution of the genus Cyanothece (Chroococcales, Cyanobacteria), with a treatment on Gloeothece and three new genera, Crocosphaera, Rippkaea, and Zehria. In: Journal of Phycology. Band 55, Nr. 3, Juni 2019, ISSN 1529-8817, S. 578–610, doi:10.1111/jpy.12853 (wiley.com – besonders Table S1).
- Anthony Dron, Sophie Rabouille, Pascal Claquin, Amélie Le Roy, Antoine Sciandra: Light–dark (12:12) cycle of carbon and nitrogen metabolism in Crocosphaera watsonii WH8501: relation to the cell cycle. In: Environmental Microbiology. 14, Nr. 4, 22. Dezember 2011, S. 967–981. doi:10.1111/j.1462-2920.2011.02675.x. PMID 22188053.
- Violaine Jacq, Céline Ridame, Stéphane L'Helguen, Fanny Kaczmar, Alain Saliot: Response of the Unicellular Diazotrophic Cyanobacterium Crocosphaera watsonii to Iron Limitation. In: PLoS ONE. 9, Nr. 1, 21. Januar 2014, ISSN 1932-6203, S. e86749. doi:10.1371/journal.pone.0086749. PMID 24466221. PMC 3897776 (freier Volltext).
- Nicole Pereira, Irina N. Shilova, Jonathan P. Zehr: Molecular markers define progressing stages of phosphorus limitation in the nitrogen-fixing cyanobacterium, Crocosphaera. In: Journal of Phycology. 52, Nr. 2, 2016, S. 274–282. doi:10.1111/jpy.12396. PMID 27037592.
- J. Wu, W. Sunda, E. A. Boyle, D. M. Karl: Phosphate depletion in the western North Atlantic Ocean. In: Science. 289, Nr. 5480, 4. August 2000, ISSN 0036-8075, S. 759–762. doi:10.1126/science.289.5480.759. PMID 10926534.
- Wiebke Mohr, Maria Paola Intermaggio, Julie LaRoche: Diel rhythm of nitrogen and carbon metabolism in the unicellular, diazotrophic cyanobacterium Crocosphaera watsonii WH8501. In: Environmental Microbiology. 12, Nr. 2, 1. Februar 2010, ISSN 1462-2920, S. 412–421. doi:10.1111/j.1462-2920.2009.02078.x. PMID 19840103.
- Jonathan P. Zehr, Bess B. Ward: Nitrogen Cycling in the Ocean: New Perspectives on Processes and Paradigms. In: Applied and Environmental Microbiology. 68, Nr. 3, 1. März 2002, ISSN 0099-2240, S. 1015–1024. doi:10.1128/AEM.68.3.1015-1024.2002. PMID 11872445. PMC 123768 (freier Volltext).
- Sonya Dyhrman, Sheean Haley: Arsenate resistance in the unicellular marine diazotroph Crocosphaera watsonii. In: Frontiers in Microbiology. 2, 1. Januar 2011, ISSN 1664-302X, S. 214. doi:10.3389/fmicb.2011.00214. PMID 22046174. PMC 3201022 (freier Volltext).
- Radu Popa, Peter K. Weber, Jennifer Pett-Ridge, Juliette A. Finzi, Stewart J. Fallon, Ian D. Hutcheon, Kenneth H. Nealson, Douglas G. Capone: Carbon and nitrogen fixation and metabolite exchange in and between individual cells of Anabaena oscillarioides. In: The ISME Journal. 1, Nr. 4, 1. August 2007, ISSN 1751-7362, S. 354–360. doi:10.1038/ismej.2007.44. PMID 18043646.
- K. J. Reddy, J. B. Haskell, D. M. Sherman, L. A. Sherman: Unicellular, aerobic nitrogen-fixing cyanobacteria of the genus Cyanothece. In: Journal of Bacteriology. 175, Nr. 5, 1. März 1993, ISSN 0021-9193, S. 1284–1292. doi:10.1128/jb.175.5.1284-1292.1993. PMID 8444791. PMC 193213 (freier Volltext).
- M. A. Schneegurt, D. M. Sherman, S. Nayar, L. A. Sherman: Oscillating behavior of carbohydrate granule formation and dinitrogen fixation in the cyanobacterium Cyanothece sp. strain ATCC 51142. In: Journal of Bacteriology. 176, Nr. 6, 1. März 1994, ISSN 0021-9193, S. 1586–1597. doi:10.1128/jb.176.6.1586-1597.1994. PMID 8132452. PMC 205243 (freier Volltext).
- P. C. Meunier, M. S. Colon-Lopez, L. A. Sherman: Temporal Changes in State Transitions and Photosystem Organization in the Unicellular, Diazotrophic Cyanobacterium Cyanothece sp. ATCC 51142. In: Plant Physiology. 115, Nr. 3, 1. November 1997, ISSN 1532-2548, S. 991–1000. doi:10.1104/pp.115.3.991. PMID 12223855. PMC 158562 (freier Volltext).
- Sophie Rabouille, Pascal Claquin: Photosystem-II shutdown evolved with Nitrogen fixation in the unicellular diazotroph Crocosphaera watsonii. (PDF) In: Environmental Microbiology. 18, Nr. 2, 2016, S. 477–485. doi:10.1111/1462-2920.13157. PMID 26643607.
- T. Cardona: A fresh look at the evolution and diversification of photochemical reaction centers. In: Photosynthesis Research. 126, Nr. 1, 2015, S. 111–134. doi:10.1007/s11120-014-0065-x. PMID 25512103. PMC 4582080 (freier Volltext).
- Mak A. Saito, Erin M. Bertrand, Stephanie Dutkiewicz, Vladimir V. Bulygin, Dawn M. Moran, Fanny M. Monteiro, Michael J. Follows, Frederica W. Valois, John B. Waterbury: Iron conservation by reduction of metalloenzyme inventories in the marine diazotroph Crocosphaera watsonii. In: Proceedings of the National Academy of Sciences. 108, Nr. 6, 8. Februar 2011, ISSN 0027-8424, S. 2184–2189. doi:10.1073/pnas.1006943108. PMID 21248230. PMC 3038740 (freier Volltext).
- Pia H. Moisander, Roxanne A. Beinart, Ian Hewson, Angelicque E. White, Kenneth S. Johnson, Craig A. Carlson, Joseph P. Montoya, Jonathan P. Zehr: Unicellular Cyanobacterial Distributions Broaden the Oceanic N2 Fixation Domain. In: Science. 327, Nr. 5972, 19. März 2010, ISSN 0036-8075, S. 1512–1514. doi:10.1126/science.1185468. PMID 20185682.
- Joseph P. Montoya, Carolyn M. Holl, Jonathan P. Zehr, Andrew Hansen, Tracy A. Villareal, Douglas G. Capone: High rates of N2 fixation by unicellular diazotrophs in the oligotrophic Pacific Ocean. In: Nature. 430, Nr. 7003, 2004, S. 1027–1032. doi:10.1038/nature02824. PMID 15329721.
- Unicellular cyanobacteria fix N2 in the subtropical North Pacific Ocean. In: Nature News. 9. August 2001. doi:10.1038/news010809-11.
- J. Keith Moore, Scott C. Doney, Keith Lindsay: Upper ocean ecosystem dynamics and iron cycling in a global three-dimensional model. In: Global Biogeochemical Cycles. 18, Nr. 4, 1. Dezember 2004, ISSN 1944-9224, S. GB4028. doi:10.1029/2004GB002220.
- C. Mark Moore, Matthew M. Mills, Eric P. Achterberg, Richard J. Geider, Julie LaRoche, Mike I. Lucas, Elaine L. McDonagh, Xi Pan, Alex J. Poulton: Large-scale distribution of Atlantic nitrogen fixation controlled by iron availability. In: Nature Geoscience. 2, Nr. 12, 2009, S. 867–871. doi:10.1038/ngeo667.
- Matthew M. Mills, Celine Ridame, Margaret Davey, Julie La Roche, Richard J. Geider: Iron and phosphorus co-limit nitrogen fixation in the eastern tropical North Atlantic. In: Nature. 429, Nr. 6989, 20. Mai 2004, ISSN 0028-0836, S. 292–294. doi:10.1038/nature02550. PMID 15152251.
- John A. Raven: The iron and molybdenum use efficiencies of plant growth with different energy, carbon and nitrogen sources. In: New Phytologist. 109, Nr. 3, 1. Juli 1988, ISSN 1469-8137, S. 279–287. doi:10.1111/j.1469-8137.1988.tb04196.x.
- James B. Howard, Douglas C. Rees: Structural Basis of Biological Nitrogen Fixation. In: Chemical Reviews. 96, Nr. 7, 1. Januar 1996, ISSN 0009-2665, S. 2965–2982. doi:10.1021/cr9500545.
- Nicole Pereira, Irina N. Shilova, Jonathan P. Zehr: Molecular markers define progressing stages of phosphorus limitation in the nitrogen-fixing cyanobacterium, Crocosphaera. In: Journal of Phycology. 52, Nr. 2, 8. März 2016, S. 274–282. doi:10.1111/jpy.12396. PMID 27037592.
- C. N. Matthews: The origin of proteins: Heteropolypeptides from hydrogen cyanide and water. In: Origins of Life. 6, Nr. 1–2, 1. Januar 1975, ISSN 0302-1688, S. 155–162. doi:10.1007/BF01372400. PMID 168535.
- AlgaeBase: Crocosphaera Zehr, Rachel A.Foster, Waterbury & E.Webb, 2019
- Julia Prechtl, Christoph Kneip, Peter Lockhart, Klaus Wenderoth, Uwe-G. Maier: Intracellular Spheroid Bodies of Rhopalodia gibba Have Nitrogen-Fixing Apparatus of Cyanobacterial Origin, in: Molecular Biology and Evolution, Band 21, Nr. 8, 1. August 2004, S. 1477–1481, doi:10.1093/molbev/msh086
- Juan José Pierella Karlusich, Eric Pelletier, Fabien Lombard, et al.: Global distribution patterns of marine nitrogen-fixers by imaging and molecular methods, in: Nature Communications, Band 12, Nr. 4160, doi:10.1038/s41467-021-24299-y
- Changling Ding et al.: Comparison of Diazotrophic Composition and Distribution in the South China Sea and the Western Pacific Ocean, in: MDPI Biology, Band 10, Nr. 6, Special Issue Biodiversity Patterns, S. 555, 20. Juni 2021, doi:10.3390/biology10060555
- Juan José Pierella Karlusich et al.: Global distribution patterns of marine nitrogen-fixers by imaging and molecular methods, in: Nature Communications, Band 12, Nr. 4160, PMC 8260585 (freier Volltext), PMID 34230473, doi:10.1038/s41467-021-24299-y
- formae speciales, auf Spektrum.de, Lexikon der Biologie. Sing.: forma specialis (f. sp.), Plural: formae speciales (ff. spp.)