Cobalt(II)-iodid
Cobalt(II)-iodid ist eine chemische Verbindung des Cobalts und zählt zu den Iodiden.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
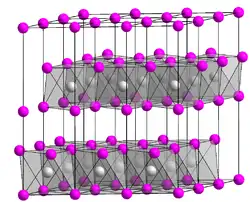 | ||||||||||||||||
| _ Co2+ _ I− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cobalt(II)-iodid | |||||||||||||||
| Andere Namen |
Cobaltdiiodid | |||||||||||||||
| Verhältnisformel | CoI2 | |||||||||||||||
| Kurzbeschreibung |
dunkel grau-grünes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 312,74 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
570 °C[3] | |||||||||||||||
| Löslichkeit |
löslich in Wasser, Schwefeloxychlorid und Phosphoroxychlorid.[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
α-Cobalt(II)-iodid kann durch Reaktion von Cobalt mit Iodwasserstoff gewonnen werden.[2]
Das Hexahydrat kann durch Reaktion von Cobalt(II)-hydroxid oder Cobalt(II)-carbonat in wässriger Iodwasserstoffsäure gewonnen werden.
Eigenschaften
α-Cobalt(II)-iodid ist eine schwarze graphitähnliche hygroskopische Masse, die an Luft langsam schwarzgrün anläuft. Sie ist löslich in Wasser, wobei die verdünnte Lösungen rot aussehen, konzentrierte Lösungen bei niedriger Temperatur rot, bei höherer Temperatur alle Nuancen von braun bis olivgrün annehmen. Cobalt(II)-iodid hat eine trigonale Kristallstruktur vom Cadmiumiodid-Typ mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164) und den Gitterparametern a = 396 pm und c = 665 pm. Das Hexahydrat bildet lange, dunkelrote Kristalle, die oberhalb 27 °C Kristallwasser abzugeben beginnen und bei 130 °C wasserfrei werden. Bei der Sublimation der α-Form im Hochvakuum entsteht das hygroskopische ockergelbe an feuchter Luft zu grünen Tropfen zerfließende β-Cobalt(II)-iodid. Dessen Lösung in Wasser ist farblos, färbt sich jedoch beim Erwärmen rosa. Die β-Form geht beim Erhitzen bei 400 °C unter Schwarzfärbung in die α-Form über.[2] Neben der Hexahydratform sind auch noch ein Di- und ein Tetrahydrat bekannt.[4]
Verwendung
Wasserfreies Cobalt(II)-iodid kann zur Erkennung von Wasser durch Farbumschlag zu Pink in Alkoholen, Ketonen, Nitrilen und einigen Estern verwendet werden.[5]
Einzelnachweise
- Datenblatt Cobalt(II) iodide, anhydrous, powder, 99.999% bei Sigma-Aldrich, abgerufen am 3. Juli 2012 (PDF).
- Georg Brauer: Handbuch der präparativen anorganischen Chemie. Walter de Gruyter 1994, ISBN 3-432-87823-0, S. 222 (eingeschränkte Vorschau in der Google-Buchsuche).
- americanelements: Cobalt Iodide: AMERICAN ELEMENTS Supplier & Tech Info
- D. Nicholls: The Chemistry of Iron, Cobalt and Nickel: Comprehensive Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-4643-0, S. 1070 (eingeschränkte Vorschau in der Google-Buchsuche).
- W. L. F. Armarego, Christina Li Lin Chai: Purification of Laboratory Chemicals. Elsevier 2003, ISBN 0-750-67571-3, S. 26 (eingeschränkte Vorschau in der Google-Buchsuche).
