Cobalt(II)-hydroxid
Cobalt(II)-hydroxid ist eine chemische Verbindung des Cobalts aus der Gruppe der Hydroxide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
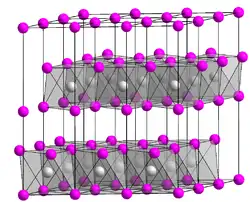 | ||||||||||||||||
| _ Co2+ _ OH− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cobalt(II)-hydroxid | |||||||||||||||
| Andere Namen |
Cobaltdihydroxid | |||||||||||||||
| Verhältnisformel | Co(OH)2 | |||||||||||||||
| Kurzbeschreibung |
rosafarbenes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 92,95 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,597 g·cm−3 (25 °C)[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung


Cobalt(II)-hydroxid fällt aus Cobalt(II)-lösungen durch Alkalilaugen je nach Wassergehalt als anfangs unbeständiger blauer, später rosaroter Niederschlag aus.[4][2]
Eigenschaften
Cobalt(II)-hydroxid ist ein nicht amphoterer, rosafarbener Feststoff[1][4] mit einer Cadmiumiodid-Kristallstruktur.[5] Er zersetzt sich bei 168 °C im Vakuum zu Cobalt(II)-oxid und wird durch Luft zu Cobalt(III)-hydroxid oxidiert. Die thermische Zersetzung an Luft bei über 300 °C ergibt Cobalt(II,III)-oxid.[6] Bei Lagerung an Luft bildet sich das braune Cobalt(III)-oxid-hydrat.[4] Cobalt(II)-hydroxid ist löslich in konzentrierten Laugen, wobei sich tiefblaue Tetrahydroxo-Cobaltat(II)-Ionen ([Co(OH)4]2−) bilden.[2]
Mit 3Co(OH)2·2H2O existiert auch ein Hydrat. Dieses ist ein blaues Pulver. Seine Kristallstruktur ist ein aus Hydroxidschichten vom Brucit-Typ bestehendes Schichtengitter, bei dem der Schichtabstand durch Einbau einer Wasserzwischenschicht aufgeweitet wird.[7]
Verwendung
Cobalt(II)-hydroxid wird als Zwischenprodukt bei der Herstellung von Cobalt verwendet.[8]
Einzelnachweise
- Datenblatt Cobalt(II) hydroxide, technical grade, 95% bei Sigma-Aldrich, abgerufen am 12. Januar 2021 (PDF).
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022566-2, S. 860 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Cobaltdihydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Karl-Heinz Lautenschläger, Werner Schröter: Taschenbuch der Chemie. Harri Deutsch Verlag, 2008, ISBN 978-3-8171-1761-1, S. 582 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1554.
- Pradyot Patnaik: Handbook of Inorganic Chemical Compounds. McGraw-Hill Professional. 2003, ISBN 0-07-049439-8, S. 243.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1665.
- Karl-Heinz Lautenschläger, Werner Schröter: Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals. Elsevier, 2011, ISBN 0-08-096810-4, S. 384 (eingeschränkte Vorschau in der Google-Buchsuche).



