Cobalt(II)-bromid
Cobalt(II)-bromid ist eine chemische Verbindung des Cobalts und zählt zu den Bromiden.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
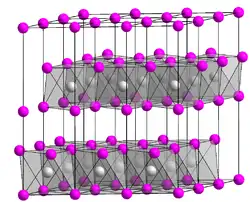 | ||||||||||
| _ Co2+ _ Br− | ||||||||||
| Allgemeines | ||||||||||
| Name | Cobalt(II)-bromid | |||||||||
| Andere Namen |
Cobaltdibromid | |||||||||
| Verhältnisformel | CoBr2 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 218,74 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich in Aceton, Ethanol und Methanol[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Cobalt(II)-bromid kann durch Reaktion von Cobalt mit Brom gewonnen werden.[1]
Es kann auch durch thermische Zersetzung des Hexahydrates bei 130–150 °C gewonnen werden.[2]
Ebenfalls möglich ist die Darstellung aus Cobalt(II)-acetat-Tetrahydrat und Acetylbromid.[2]
Eigenschaften
Cobalt(II)-bromid ist ein grüner hygroskopischer Feststoff,[3][1] der an der Luft in das rote Hexahydrat übergeht. In Wasser ist es mit roter Farbe leicht löslich. Cobalt(II)-bromid besitzt eine Cadmiumiodid-Kristallstruktur.[6] Das rote Hexahydrat zerfließt an Luft. Es gibt über konzentrierter Schwefelsäure oder beim Erhitzen auf 130–140 °C alles Kristallwasser ab.[2] Bei 100 °C gibt das Hexahydrat Kristallwasser ab und geht in das lilafarbene Dihydrat über.[4] Das Dihydrat hat eine Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12) und den Gitterparametern a = 7,630, b = 8,770, c = 3,765 Å und β = 97,54°.[7]
Verwendung
Cobalt(II)-bromid kann als Katalysator bei der Oxidation von organischen Verbindungen verwendet werden.[8]
Einzelnachweise
- Erwin Riedel: Anorganische Chemie. 6. Auflage, Walter de Gruyter, 2004, ISBN 3-11-018168-1, S. 834.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1661.
- Datenblatt Cobalt(II) bromide, 99 % bei Sigma-Aldrich, abgerufen am 21. Juni 2017 (PDF).
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 483 (eingeschränkte Vorschau in der Google-Buchsuche).
- G.J.A. Speijers, E.I. Krajnc, J.M. Berkvens, M.J. van Logten: Acute oral toxicity of inorganic cobalt compounds in rats. In: Food and Chemical Toxicology. Band 20, Nr. 3, Juni 1982, S. 311–314, doi:10.1016/S0278-6915(82)80298-6.
- Cobalt dibromide. In: webelements.com. Abgerufen am 21. Juni 2017 (englisch).
- B. Morosin: Crystal Structure of Manganese (II) and Cobalt (II) Bromide Dihydrate. In: The Journal of Chemical Physics. 47, 1967, S. 417, doi:10.1063/1.1711911.
- Datenblatt Cobalt(II) bromide hydrate bei Sigma-Aldrich, abgerufen am 30. Januar 2012 (PDF).


