Chromene
Als Chromene (auch: Benzopyrane) werden die beiden organischen chemischen Verbindungen 2H-Chromen und 4H-Chromen bezeichnet. Diese zählen zu den aromatischen Verbindungen und zu den Heterocyclen, da im Ringsystem das Heteroatom Sauerstoff enthalten ist. Beide Substanzen sind Isomere, die sich nur durch die Lage der Doppelbindung im heterocyclischen Sechsring unterscheiden.
| Chromene | |||
| Name | 2H-Chromen | 4H-Chromen | |
| Andere Namen | 2-Benzopyran | 4-Benzopyran | |
| Strukturformel | 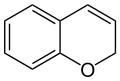 |
 | |
| CAS-Nummer | 254-04-6 | 254-03-5 | |
| ? (Isomerengemisch) | |||
| PubChem | 9211 | 136068 | |
| Summenformel | C9H8O | ||
| Molare Masse | 132,16 g·mol−1 | ||
| Aggregatzustand | flüssig | ||
| Kurzbeschreibung | |||
| Schmelzpunkt | < 25 °C[1] | ? °C | |
| Siedepunkt | 92 °C (13 mbar)[2] | 77 °C (10 mbar)[3] | |
| Dichte | 1,10 g·cm−3[4] | ? g·cm−3 | |
| Löslichkeit | unlöslich in Wasser[4] | ||
| GHS- Kennzeichnung [5] |
| ||
| H- und P-Sätze | siehe oben | ||
| siehe oben | |||
| siehe oben | |||
| Toxikologische Daten | 250 mg·kg−1 (LD50, Maus, i.p.)[1][6] | ||
Vorkommen, Derivate und Verwendung
2H-Chromen kommt in dem Myrtengewächs Calyptranthes tricona vor. Derivate des 2H-Chromens wirken als potente Kaliumkanalöffner und werden als Arzneistoffe verwendet (Cromakalim, Lemakalim);[7] Carbocromen wird zur Herztherapie eingesetzt. Vom 2H-Chromen leiten sich Cumarin und Umbelliferon ab, vom 4H-Chromen das Chromon, die Anthocyanidine und Flavone. Durch Hydrierung des Pyran-Ringes erhält man das Chroman, das z. B. den Grundbaustein der Tocopherole, der Rotenoide und einiger Cannabinoide darstellt. Auch viele Alkaloide enthalten ein Chromen-Gerüst als Chromophor.[8]
Isochromene
Stellungsisomere der beiden Chromene sind das 1H-Isochromen und das 3H-Isochromen, bei denen sich das Sauerstoff-Atom in Position 2 befindet.
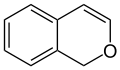 1H-Isochromen
1H-Isochromen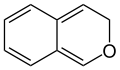 3H-Isochromen
3H-Isochromen
Darstellung
Eine einfache Einstufensynthese von 2H-Chromen nach Yoshiyuki Kawase ist durch direkte Cyclisierung von Salicylaldehyd mit Propencarbonsäureestern in DMF möglich.[9][7] Die Synthese von 2H-Chromen erfolgt auch durch eine Wittig-Reaktion und anschließendem Ringschluss ausgehend vom Natriumsalz des Salicylaldehyds und Vinyltriphenylphosphoniumbromid.[2]
Literatur
- Eintrag zu Chromene. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2015.
Einzelnachweise
- Eintrag zu 1,2-Benzopyran in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021.
- Scheweizer, E.E.: Reactions of Phosphorus Compounds. III. A New General Ring Synthesis from Vinyltriphenylphosphonium Bromide in J. Am. Chem. Soc. 86 (1964) 2744. doi:10.1021/ja01067a061
- D. R. Lide, G. W. A. Milne: Handbook of Data on Organic Compounds. 3. Auflage, CRC Press, 1994, ISBN 9780849304453, S. 1548.
- D. R. Lide, G. W. A. Milne: Handbook of Data on Common Organic Compounds. CRC Press, 1995, ISBN 9780849304040, S. 568.
- In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- European Journal of Medicinal Chemistry. Vol. 11, S. 81, 1976.
- Sabine Plücker: Untersuchungen zur Darstellung von Radioliganden aus der Reihe der Kaliumkanalöffner vom Benzopyran-Typ (PDF; 2,0 MB), Dissertation an der Heinrich-Heine-Universität Düsseldorf, 2004.
- I. W. Southon, G. A. Cordell, J. Buckingham: Dictionary of alkaloids. CRC Press, 1989, ISBN 9780412249105.
- Kawase, Y., Yamaguchi, S., Horita, H., Takeno, J., Kameyama, H.: Bull. Chem. Soc. Jpn., 1982, 55, 1153–1155.