Chlorameisensäureisopropylester
Chlorameisensäureisopropylester ist eine organisch-chemische Verbindung aus der Stoffgruppe der Chlorameisensäureester (eigentlich korrekterweise Chlorkohlensäureester). Es wird vor allem als Zwischenprodukt bei der Herstellung von Pflanzenschutzmitteln verwendet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chlorameisensäureisopropylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H7ClO2 | ||||||||||||||||||
| Kurzbeschreibung |
flüchtige, farblose Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 122,55 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
104,6 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
zersetzt sich in Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,4013 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Nomenklatur
Der gebräuchliche Name „Chlorameisensäureisopropylester“ ist nicht korrekt, da die Verbindung kein Derivat der Ameisensäure, sondern der Kohlensäure (Kohlensäuremonochlorid und Kohlensäuremonoester) ist.[3]
Gewinnung und Darstellung
Die technische Herstellung von Chlorameisensäureisopropylester erfolgt aus Phosgen und wasserfreiem Isopropanol bei Temperaturen von 30–70 °C unter Abspaltung von Chlorwasserstoff.[4]
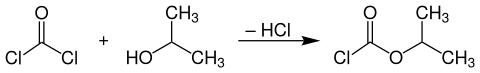
Die Umsetzung erfolgt kontinuierlich im Gleich- oder Gegenstrom. Beim Gleichstromverfahren wird in Rührkesselreaktoren, Reaktoren mit eingebauter Zerstäuberdüse oder Umlaufreaktoren gearbeitet, wohingegen man für die Gegenstromanordnung in der Regel eine Füllkörperkolonne verwendet, bei der überschüssiges Phosgen zusammen mit gasförmigem Chlorwasserstoff am Kopf der Kolonne austritt und der Chlorameisensäureester im Sumpf angereichert wird.[4]
Eigenschaften
Chlorameisensäureisopropylester ist ein flüchtige, farblose bis gelbliche Flüssigkeit mit stechendem Geruch, welche sich in Wasser zersetzt.[1] Das technische Produkt wird in Lösung mit Toluol ausgeliefert.[5]
Verwendung
Chlorameisensäureisopropylester wird vor allem zur Herstellung von Carbonaten und Carbamaten verwendet, die als Pflanzenschutzmittel eingesetzt werden. Es ist beispielsweise ein Zwischenprodukt bei der Produktion der Herbizide Chlorpropham, Phenisopham und Propham, des Fungizids Diethofencarb sowie des Akarizids und Fungizids Dinobuton.
Sicherheitshinweise
Die Dämpfe von Chlorameisensäureisopropylester können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 17 °C) bilden.[1] Katalysiert durch in Verunreinigungen enthaltenen Eisenionen, im einfachsten Fall Rost kann sich die Verbindung auch nach längerer Lagerung explosionsartig zersetzen.[6]
Einzelnachweise
- Eintrag zu Isopropylchlorformiat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-314.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 430 (eingeschränkte Vorschau in der Google-Buchsuche).
- Siegfried Böhm, Maren Beth-Hübner: Chloroformic Esters. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. April 2006, doi:10.1002/14356007.a06_559.pub2.
- Datenblatt Isopropyl chloroformate solution , 1.0 M in toluene bei Sigma-Aldrich, abgerufen am 22. August 2011 (PDF).
- P.G. Urben, M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 8. Edition, Vol. 1, Butterworth/Heinemann 2017, ISBN 978-0-08-100971-0, S. 346.


