Asterane
Asterane (von altgriechisch ἀστήρ astēr und lateinisch astrum für „Stern“) sind eine Gruppe polycyclischer Kohlenwasserstoffe mit einer sternartigen Käfigstruktur. Diese Verbindungen leiten sich von Cyclohexan-Ringen ab, die in der Bootkonformation an „Bug“ und „Heck“ miteinander verknüpft sind. Die gegenüber der Sesselkonformation energiereichere und damit instabilere Bootkonformation wird dadurch fixiert.[1]
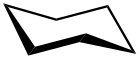 Sesselkonformation
Sesselkonformation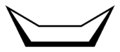 Bootkonformation
Bootkonformation
Die Bezeichnung Asterane wurde 1965 von Hans Musso geprägt, dessen Arbeitsgruppe sich in den Folgejahren mit der Synthese verschiedener Vertreter dieser Kohlenwasserstoffe beschäftigte.
Strukturen
Je nach Anzahl der Cyclohexaneinheiten im Molekül werden die Vertreter der Stoffgruppe als Di-, Tri-, Tetra-, Pentaasterane usw. bezeichnet.
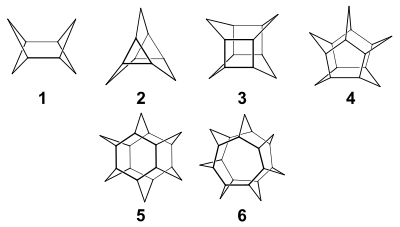
5: Hexaasteran, 6: Heptaasteran
Eigenschaften
Von Interesse bei den Asteranen ist die 1,4-Wechselwirkung der Wasserstoffatome zwischen "Bug" und "Heck" in der Cycolohexan-Wannenkonformation; der Abstand zwischen diesen H-Atomen nimmt von Tri-, über das Tetra- zum Pentaasteran immer weiter ab.[2]

Die von vornherein energetisch ungünstigere Bootskonformation wird durch dieses Aufeinanderpressen von „Bug“ und „Heck“ noch ungünstiger, so dass ungewöhnliche Bindungslängen, Bindungswinkel und intramolekulare Abstände resultieren, die sich in ungewöhnlichen spektroskopischen und chemischen Eigenschaften niederschlagen.[3]
Darstellung von Asteranen
Bislang wurden Synthesen von Di-, Tri- und Tetraasteran veröffentlicht.
Triasteran
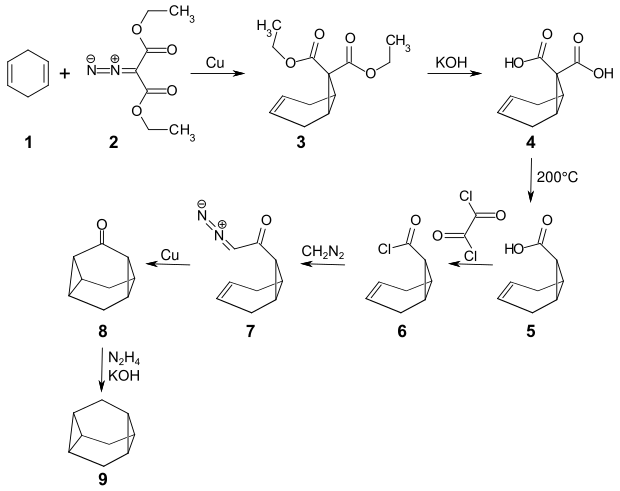
Das erste Beispiel einer Asteran-Synthese war 1965 die Darstellung von Triasteran. Dabei wird zunächst 1,4-Cyclohexadien 1 mit Diazomalonsäurediethylester 2 unter Kupfer-Katalyse zu dem Norcarendicarbonsäurediethylester 3 umgesetzt. Die Verseifung mit KOH ergibt die Norcarendicarbonsäure 4, die sich bei 200 °C zur Norcarencarbonsäure 5 decarboxylieren lässt.[4] Durch Umsetzung mit Oxalylchlorid erhält man das Säurechlorid 6, das mit Diazomethan zu dem Diazoketon 7 reagiert. Dieses zersetzt sich in siedendem Hexan und in Gegenwart von Cu-Pulver unter Stickstoffabspaltung zu dem Triasteranon 8. Die Wolff-Kishner-Reduktion mit Hydrazin und Kaliumhydroxid (KOH) liefert das Triasteran[5] 9.[2]
Tetraasteran
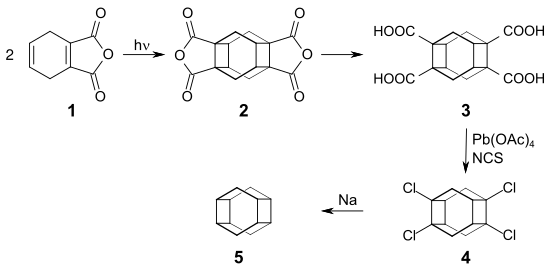
Eine 1975 veröffentlichte Tetraasteran-Synthese geht von 3,6-Dihydrophthalsäureanhydrid 1 aus. Durch Belichten in Dioxan erhält man das dimere Anhydrid 2, in dem bereits das Tetraasteran-Grundgerüst vorliegt. Das Anhydrid wird zur Tetracarbonsäure 3 abgebaut, die sich in einer Kochi-Reaktion nach einer Variante von Cyril A. Grob mit Bleitetraacetat und N-Chlorsuccinimid[6] in das Tetrachlorid 4 überführen lässt. Zwischenprodukt 4 wird mit Natrium zum Tetraasteran[7] 5 reduziert.[8]
Das Bistetraasteran ist eine Verbindung mit zwei verknüpften Tetraasteran-Einheiten.[9]
Diasteran
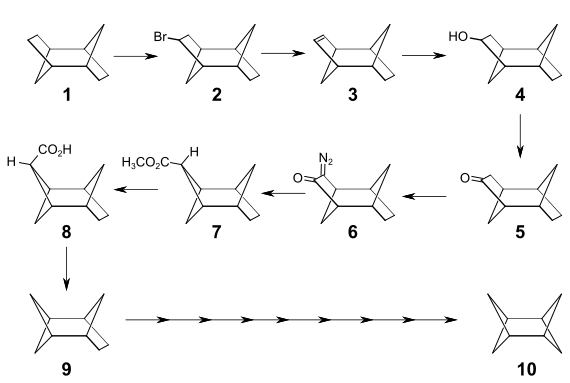
Die Synthese von Diasteran gelang 1986 in einer vielstufigen Reaktion. Ausgehend von Tricyclo[4.2.1.12,5]decan 1 erhält man durch eine photochemische Bromierung in Tetrachlorkohlenstoff bei 140 °C das Bromid 2, das durch eine Dehydrobromierung mit DBU in das Olefin 3 überführt werden kann. Durch eine Hydroborierung ist der Alkohol 4 zugänglich, der mit Dimethylsulfoxid und Oxalylchlorid zu dem Keton 5 oxidiert wird. Durch eine α-Formylierung und anschließender Umsetzung mit Tosylazid erhält man das Diazoketon 6. Die Photolyse und Wolff-Umlagerung dieser Verbindung ergibt den endo-Methylester 7 und nach der Esterverseifung die exo-Carbonsäure 8. Die Decarboxylierung zu Tricyclo[3.2.1.12,4]nonan 9 kann nach einem Verfahren von Derek H. R. Barton et al.[10] durchgeführt werden. Durch Wiederholung der gleichen Reaktionssequenz wird eine Ringverengung in der zweiten Molekülhälfte erreicht und man erhält das Diasteran 10.[11]
Hypothetische Asterane
Trotz mehrerer Versuche und verschiedener Methoden konnte das Pentaasteran bislang nicht synthetisiert werden.[12][13] Es ist somit, wie die beiden nächsten Verbindungen in der Asteran-Reihe – das Hexa- und das Heptaasteran – eine hypothetische Verbindung.
Siehe auch
Einzelnachweise
- Eintrag zu Asterane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Oktober 2019.
- U. Biethan, U.v. Gizycki, H. Musso: Asterane. In: Tetrahedron Letters. Band 6, Nr. 20, Januar 1965, S. 1477, doi:10.1016/s0040-4039(00)90092-3.
- Henning Hopf: Über Hans Musso (1925–1988) und sein wissenschaftliches Werk. In: Chemische Berichte. Band 125, Nr. 2, Februar 1992, doi:10.1002/cber.19921250202.
- Uwe Biethan, Hans Musso: endo- und exo-Δ3-Norcaren-carbonsäure-(7). In: Chemische Berichte. Band 97, Nr. 8, August 1964, S. 2282, doi:10.1002/cber.19640970826.
- Externe Identifikatoren von bzw. Datenbank-Links zu Triasteran: CAS-Nummer: 3105-29-1, PubChem: 137827, ChemSpider: 121477, Wikidata: Q74755828.
- K. BECKER, M. GEISEL, C. GROB, F. KUHNEN: Improved Preparation of Tertiary Chlorides by Halodecarboxylation. In: Synthesis. Band 1973, Nr. 08, 18. März 2002, S. 493, doi:10.1055/s-1973-22243.
- Externe Identifikatoren von bzw. Datenbank-Links zu Tetraasteran: CAS-Nummer: 259-77-8, PubChem: 12316943, ChemSpider: 16736514, Wikidata: Q74754213.
- Hans-Martin Hutmacher, Hans-Günter Fritz, Hans Musso: Tetraasteran, Pentacyclo[6.4.0.02,7.04,11.05,10]-dodecan. In: Angewandte Chemie. Band 87, Nr. 5, März 1975, S. 174, doi:10.1002/ange.19750870511.
- Volker Thomas Hoffmann, Hans Musso: Asterane, XXII. Synthese eines doppelten Tetraasterans: Nonacyclo[10.8.0.02,11.04,9.04,19.06,17.07,16.09,14.014,19]eicosan. In: Chemische Berichte. Band 124, Nr. 1, Januar 1991, S. 103, doi:10.1002/cber.19911240118.
- Derek H. R. Barton, David Crich, William B. Motherwell: The invention of new radical chain reactions. Part VIII. Radical chemistry of thiohydroxamic esters; A new method for the generation of carbon radicals from carboxylic acids. In: Tetrahedron. Band 41, Nr. 19, Januar 1985, S. 3901, doi:10.1016/s0040-4020(01)97173-x.
- Andreas Otterbach, Hans Musso: Diasteran (Tricyclo[3.1.1.12,4]octan). In: Angewandte Chemie. Band 99, Nr. 6, Juni 1987, S. 588, doi:10.1002/ange.19870990624.
- Klaus Ebel, Heinz Krüger, Hans Musso: Asterane, XX. Studien in der Pentaasteranreihe. In: Chemische Berichte. Band 121, Nr. 2, Februar 1988, S. 323, doi:10.1002/cber.19881210219.
- Axel Bader, Klaus Ebel, Hans Musso, Norbert Skuballa: Asterane, XXI. Weitere Versuche zur Synthese des Pentaasterans. In: Chemische Berichte. Band 121, Nr. 2, Februar 1988, S. 327, doi:10.1002/cber.19881210220.