Bistetraasteran
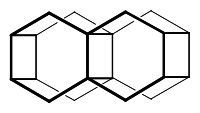
Bistetraasteran ist ein gesättigter polycyclischer C20H24-Kohlenwasserstoff mit einer käfigartigen Struktur aus der Gruppe der Asterane.[3][4]
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Allgemeines | |||||||
| Name | Bistetraasteran | ||||||
| Andere Namen |
Nonacyclo[10.8.0.02,11.04,9.04,19.06,17.07,16.09,14.014,19]eicosan | ||||||
| Summenformel | C20H24 | ||||||
| Kurzbeschreibung |
farblose Nadeln[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 264,19 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt |
230–235 °C[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Darstellung
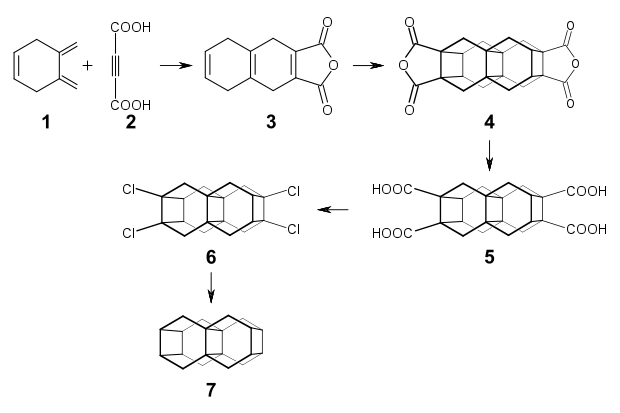
Die Darstellung von Bistetraasteran, die sich an dem Synthesekonzept von Tetraasteran aus dem Jahr 1975 orientiert, wurde 1987 beschrieben. Ausgangsverbindung ist das Dimethylencyclohexen 1, das mit Acetylendicarbonsäure 2 in Dioxan im Sinne einer Diels-Alder-Reaktion umgesetzt wird. Bei dieser Umsetzung erhält man mit einer Ausbeute von 60 % direkt das Anhydrid der Tetrahydronaphthalin-Verbindung 3. Die Belichtung dieses Anhydrids in Gegenwart von Benzophenon mit einer Quecksilberhochdrucklampe ergibt mit einer Ausbeute von 8 % ein Isomerengemisch aus mindestens vier Dimeren, welches die Verbindung 4 mit einem Anteil von 46 % enthält. Das Bisanhydrid 4 kann mit Natronlauge in 90 % Ausbeute zur Tetracarbonsäure 5 verseift werden. Die Umsetzung mit Bleitetraacetat und N-Chlorsuccinimid im Sinne einer Kochi-Reaktion nach einer Variante von Grob liefert die Tetrachlorverbindung 6, die mit einer nicht näher charakterisierten Pentachlorverbindung verunreinigt ist. Mit Natrium, in einer Mischung von Ethanol und THF als Lösungsmittel, gelingt die Dehalogenierung zu dem Bistetraasteran 7 in einer Ausbeute von 21 %.[1]
Eigenschaften
Im Bistetraasteran sind die acht miteinander verknüpften Cyclohexanringe in der Bootskonformation fixiert. So wie man die Verbindungen Adamantan oder Diamantan als Teilsegmente des Diamantgitters ansehen kann, sind Tetraasteran und Bistetraasteran Teile einer hypothetischen Kohlenstoffmodifikation mit einem Tetraasterangitter. Während im Diamantgitter die horizontalen und vertikalen Ebenen durch Cyclohexanringe in der energetisch günstigeren Sesselkonformation gebildet werden, würden im Tetraasterangitter die Cyclohexanringe sowohl in den horizontalen, als auch in den vertikalen Schichten in der Bootskonformation vorliegen.[5]
Bistetraasteran kann durch Sublimation bei 80–100 °C und 0,3 mbar gereinigt werden und kristallisiert aus Methanol in farblosen Nadeln.[1]
Einzelnachweise
- Volker Thomas Hoffmann, Hans Musso: Asterane, XXII. Synthese eines doppelten Tetraasterans: Nonacyclo[10.8.0.02,11.04,9.04,19.06,17.07,16.09,14.014,19]eicosan. In: Chemische Berichte. Band 124, Nr. 1, Januar 1991, S. 103, doi:10.1002/cber.19911240118.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Volker T. Hoffmann: Synthese von Nonacyclo[10.8.0.02,11.04,9.04,19.06,17.07,16.09,14.014,19]eicosan (Bis-Tetraasteran). Dissertation, Universität Karlsruhe (TH). Karlsruhe 1987.
- Volker T. Hoffmann, Hans Musso: Nonacyclo[10.8.0.02,11.04,9.04,19.06,17.07,16.09,14.014,19]-icosan, ein doppeltes Tetraasteran. In: Angewandte Chemie. Band 99, Nr. 10, Oktober 1987, S. 1036, doi:10.1002/ange.19870991008.
- Günther Kaiser, Hans Musso: Asterane, XVII. Über die Synthese von [4]Propellanderivaten des Tetraasterans. In: Chemische Berichte. Band 118, Nr. 6, Juni 1985, S. 2266, doi:10.1002/cber.19851180610.