Anodische Oxidation
Bei der anodischen Oxidation werden Substanzen oxidiert, wobei gleichzeitig ein elektrischer Strom durch einen äußeren Stromkreis fließt. Oxidation bedeutet, dass eine Substanz Elektronen abgibt. Diese werden durch eine Elektrode, die Anode, aufgenommen.[1]
Unterschiede
Es gibt unterschiedliche Arten der anodischen Oxidation:
- in galvanischen Zellen und in Batterien verläuft die Reaktion 'freiwillig', d. h. unter Energieabgabe. Die Stoffe, die oxidiert werden, geben ihre Elektronen an die Anode ab, die sich dadurch negativ auflädt. Die Anode ist Minuspol der galvanischen Zelle bzw. der Batterie.
- in Elektrolysezellen wird die Oxidationsreaktion durch eine von außen angelegte Spannung erzwungen. Der Entzug von Elektronen erfolgt am Pluspol, der die Elektronen aufnimmt: die Anode ist der Pluspol von Elektrolysezellen.[2] Der bei Elektrolyse von Säure- und Salzlösungen an der Anode stattfindende Sekundärprozeß, wenn das entladene „Anion“ nicht existenzfähig ist, führt bei unangreifbarer Anode zum Freiwerden von gasförmigem Sauerstoff durch Oxidation von Hydroxid-Ionen.[1]
Durch die anodische Oxidation bei einer Elektrolyse können auch sehr stabile und reaktionsträge Stoffe oxidiert werden, beispielsweise ist es möglich Chlorid zum Chlor[3] und Fluorid zum Fluor zu oxidieren. Letzteres ist wegen des Standardpotential von Fluor die einzige Methode zur Herstellung von elementarem Fluor aus Fluoridionen.[4] Mit leistungsfähigen Gleichstromquellen verbundene Anoden sind die stärksten Oxidationsmittel. Da sie stärker sind als alle chemischen Oxidationsmittel, erlaubt die anodische Oxidation die Darstellung auch der stärksten Oxidationsmittel wie Peroxodisulfat, Chlor und Fluor in guter Ausbeute.[5]
Jede Oxidation kann nur ablaufen, wenn die dabei abgegebenen Elektronen von anderen Substanzen aufgenommen werden, die dabei reduziert werden. Oxidation und Reduktion laufen immer gleichzeitig ab, es findet eine Redoxreaktion statt. Im Falle der anodischen Oxidation findet die Reduktion an der Elektrode statt, die Elektronen abgibt, an der Kathode. Die anodische Oxidation stellt damit den Gegensatz zur kathodischen Reduktion dar. Im Vergleich zu den rein chemischen Redoxreaktionen ist das Besondere bei den elektrochemischen Prozessen anodische Oxidation und kathodischer Reduktion, dass sie räumlich getrennt sind, an verschiedenen Elektroden ablaufen, und dass gleichzeitig ein Strom durch einen äußeren Stromkreis fließt. Bei elektrochemischen Prozessen finden die beiden Vorgänge zwar meistens räumlich getrennt ab, aber nur gleichzeitig im geschlossenen Stromkreis. Es ist also unmöglich eine anodische Oxidation oder eine kathodische Reduktion alleine durchzuführen, auch wenn das technisch oft wünschenswert wäre.[6]
Eine nicht gewünschte Form der anodischen Oxidation ist die elektrochemische Korrosion.[7]
Anwendungen
Die anodischen Oxidation findet vielfältige Verwendung in Bereich der Chemie, der Verfahrens- und Umwelttechnik. So vermag sie z. B. bestimmte Metalle zu oxidieren. Dies nutzt man z. B. zur Herstellung von oxidischen Schutzschichten auf Metallen aus, vor allem Leichtmetallen (sogenanntes Anodisieren).[8] Die Schichten, die durch Umwandlung der obersten Metallschichten entstehen und bis zu 40 μm Dicke erreichen können, sind bei einigen Metallen zunächst mikroporös und daher mit organischen Farbstoffen leicht anfärbbar. Sie müssen noch einer Nachverdichtung (Heißwasser-, Dampf-, Metallsalz-Nachverdichtungsverfahren) unterzogen werden und erfüllen dann dekorative und funktionelle Aufgaben. Eine Spezialform der anodischen Oxidation ist das Eloxieren von Aluminium durch elektrolytische oder plasmaelktrolytische anodische Oxidation[9], aber auch Magnesium und Zink lassen sich gut anodisieren. Ventilmetalle wie Titan und Tantal bilden einen dichten Oxidfilm, welcher bei geringer Schichtdicke (kleiner 1 μm) mit dem metallischen Untergrund Interferenzfarben bildet. Beim Titan wird dieser Effekt für dekorative Zwecke z. B. in der Schmuck- und Uhrenindustrie eingesetzt.[1] Bei Silber kann durch anodische Oxidation Silber(III)-oxid aus Silber(I)-Verbindungen hergestellt werden.[10]
Die anodischen Oxidation wird ebenfalls zur Erzeugung elektrisch isolierender Oxidschichten genutzt, die als Dielektrika in Elektrolytkondensatoren genutzt werden. Früher wurde sie auch in Gleichrichtern verwendet.
Auch in der Synthese von organischen Stoffen ist die anodische Oxidation eine nützliche Methode.[2] Eine Vielzahl organischer Verbindungen, z. B. ungesättigte Kohlenwasserstoffe[2], Aromaten, Amide, Amine[11], Carbonsäuren (Kolbe-Elektrolyse[2]) kann anodisch oxidiert werden. Die anodische Oxidation kann auch zur Entkeimung von mikrobiell belastetem Wasser eingesetzt werden. Hierbei werden Oxidantien erzeugt, die mikrozid sind und das Wasser desinfizieren.[1]
Elektrolyseverfahren
Bei der Chloralkalielektrolyse findet eine anodische Oxidation von Chlorid statt.[3] Dabei bildet sich Chlorgas:
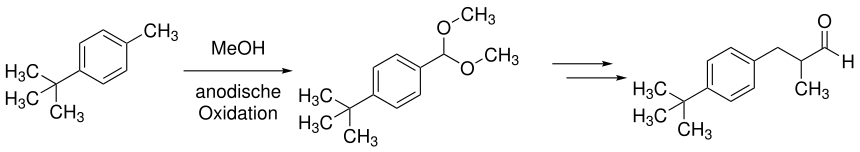
Eine weitere wichtige Anwendung der anodischen Oxidation findet sich in der Herstellung von 2-(4-tert-Butylbenzyl)propionaldehyd durch BASF. Im ersten Schritt der Synthese wird eine doppelte anodische Oxidation mit Methanol durchgeführt, um ein Acetal zu erhalten.[12]
Galvanische Zellen
In Alkali-Mangan-Zellen erfolgt die anodische Oxidation von Zink: . Bei der Entladung von Lithium-Ionen-Akkus geht am Minuspol Lithium in Lösung, es findet die anodische Oxidationsreaktion statt. In Lithiumbatterien lösen sich Lithiumionen aus einer Folie aus Lithiummetall: .
Einzelnachweise
- Eintrag zu anodische Oxidation. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Mai 2016.
- Sidney D. Ross, Manuel Finkelstein, Eric J. Rudd: Anodic Oxidation Organic Chemistry: A Series of Monographs. Elsevier, 2013, ISBN 978-1-4832-1986-8, S. 211 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ralf Steudel: Chemie der Nichtmetalle Synthesen - Strukturen - Bindung – Verwendung. Walter de Gruyter, 2014, ISBN 978-3-11-030797-9, S. 538 (eingeschränkte Vorschau in der Google-Buchsuche).
- Naumann: Fluor und Fluorverbindungen. Springer-Verlag, 2013, ISBN 978-3-642-72344-5, S. 3 (eingeschränkte Vorschau in der Google-Buchsuche).
- Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner: Industrielle Anorganische Chemie. John Wiley & Sons, 2013, ISBN 978-3-527-64958-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- Arno Behr, David W. Agar, Jakob Jörissen: Einführung in die Technische Chemie. Springer-Verlag, 2009, ISBN 978-3-8274-2195-1, S. 228 (eingeschränkte Vorschau in der Google-Buchsuche).
- Horst Briehl: Chemie der Werkstoffe. Springer-Verlag, 2014, ISBN 978-3-658-06225-5, S. 108 (eingeschränkte Vorschau in der Google-Buchsuche).
- Engelbert Westkämper, Hans-Jürgen Warnecke: Einführung in die Fertigungstechnik. Springer-Verlag, 2011, ISBN 978-3-8348-9798-5, S. 196 (eingeschränkte Vorschau in der Google-Buchsuche).
- Günter Spur: Handbuch Wärmebehandeln und Beschichten. Carl Hanser Verlag GmbH Co KG, 2015, ISBN 978-3-446-43003-7, S. 21 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hans P. Latscha, Helmut Klein: Anorganische Chemie Chemie-Basiswissen I. Springer-Verlag, 2013, ISBN 978-3-662-05762-9, S. 416 (eingeschränkte Vorschau in der Google-Buchsuche).
- Houben-Weyl Methods of Organic Chemistry Vol. IV/1b, 4th Edition Metallic and Organic Oxidation Agents, Antioxidants. Georg Thieme Verlag, 2014, ISBN 3-13-179684-7, S. 1019 (eingeschränkte Vorschau in der Google-Buchsuche).
- Cian Kingston, Maximilian D. Palkowitz, Yusuke Takahira, Julien C. Vantourout, Byron K. Peters: A Survival Guide for the “Electro-curious”. In: Accounts of Chemical Research. Band 53, Nr. 1, 21. Januar 2020, ISSN 0001-4842, S. 72–83, doi:10.1021/acs.accounts.9b00539.