Ambrox
Ambrox (auch Ambroxan) ist eine trizyklische, sesquiterpenoide chemische Verbindung[5]. Sie wurde als einer der Stoffe identifiziert, die für den charakteristischen Geruch der grauen Ambra verantwortlich sind, einem der wertvollsten tierischen Duftstoffe neben Zibet und Moschus.[6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
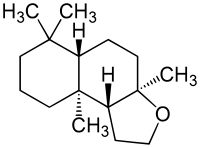 | |||||||||||||||||||
| Strukturformel von (−)-Ambrox | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ambrox | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C16H28O | ||||||||||||||||||
| Kurzbeschreibung |
kristalliner Feststoff mit charakteristischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 236,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
0,939 g·cm−3 [(−)-Ambrox][2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
120 °C [1,4 mm Hg, (−)-Ambrox][3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen

Ambrox entsteht durch die Reaktion von Ambrein (Hauptbestandteil der grauen Ambra, einer wachsartigen Substanz aus dem Verdauungstrakt von Pottwalen) mit Luftsauerstoff. Als Zersetzungsprodukt von (Labdan-)Diterpenen kann Ambrox in geringen Mengen auch in folgenden Quellen vorkommen:
- im Tabak (Nicotiana tabacum) (aus (Z)-Abienol)[7],
- im Muskatellersalbei (Salvia sclarea) (aus Sclareol)[8],
- in der Zistrose (Cistus ladanifer und Cistus creticus) (aus Labdanolsäure)[9],
- in der Trauerzypresse (Cupressus sempervirens)[10]
- und in der Adipocire der menschlichen Wachsleiche (aus Ambrein)[11].
Gewinnung und Darstellung
Zur Gewinnung von Ambrox wird Ambrein nicht mehr verwendet, es wird als Ausgangsstoff durch Sclareol aus Salvia sclarea ersetzt. Durch die Publikation der ersten Partialsynthese im Jahre 1950 von der Firma Firmenich wurde eine alternative Ambrox-Quelle gefunden. Schlüsselschritt der technischen Synthese ist der oxidative Abbau der Seitenkette mit Chromtrioxid CrO3. Die anschließende Reduktion des Lactons mit Lithiumaluminiumhydrid führt zum Diol, welches in Gegenwart von Säuren zum gewünschten Ether cyclisiert. Als Nebenprodukt kann das thermodynamisch stabilere 9b-epi-Ambrox entstehen. Die Reaktion ist im industriellen Maßstab mit einer Ausbeute von 54 % durchführbar.[12]
Nach dem Auslaufen des Patentes Anfang der 1980er Jahre wurden weitere, technisch realisierbare Syntheserouten veröffentlicht. Eine Abbaureaktion von Sclareol mittels Natriumperiodat (anstelle von Kaliumpermanganat) wurde im Arbeitskreis von Sir Derek H. R. Barton publiziert und zum Patent angemeldet.[13]
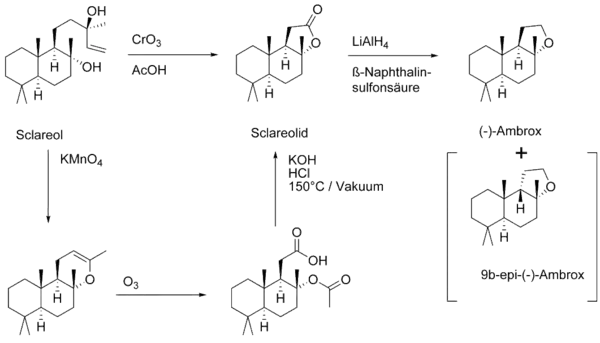
Obwohl die Syntheseschritte verhältnismäßig einfach und sicher durchgeführt werden können, liegt der große Nachteil in diesen Synthesen in der fluktuierenden Versorgungslage und somit stark variierenden Preisen von Sclareol.[14]
Als Alternative zu Sclareol kann auch (+)-cis-Abienol zur Herstellung von Ambrox verwendet werden. (+)-cis-Abienol gewinnt man aus Kanadabalsam.[12]
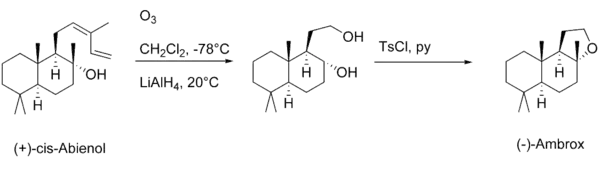
Mittels Ozonolyse von (+)-cis-Abienol und anschließender reduktiven Aufarbeitung, erhält man ein Diol, welches mit Tosylchlorid in Pyridin mit exzellenten Ausbeuten zu Ambrox cyclisiert werden kann.[15] Neben dieser synthetisch betrachtet besonders geschickten Abbaureaktion, kann Ambrox auch noch ausgehend von einer Reihe anderer Naturstoffe [(−)-Drimenol[16] , (−)-Thujon[17] oder auch (+)-Carvon[18]] gewonnen werden.
Verwendung und Eigenschaften
Ambrox ist ein schon seit dem Altertum bekannter Duftstoff, der bei der Parfümherstellung verwendet wird.
Die unterschiedlichen Stereoisomere von Ambrox haben einen vergleichbaren Duft, unterscheiden sich aber in ihren Geruchsschwellen.[19]
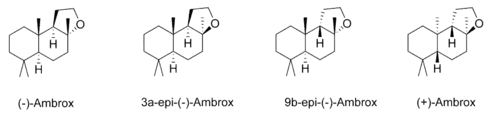
| Isomer | Geruchsschwelle in ppb |
|---|---|
| (−)-Ambrox | 0,3 |
| 3a-epi-(−)-Ambrox | 34 |
| 9b-epi-(−)-Ambrox | 0,15 |
| (+)-Ambrox | 2,4 |
Die Weltjahresproduktion für Ambrox und Analoga liegt bei etwas mehr als 30 Tonnen.[20]
Handelsnamen
- Ambro, Ambroxan, Amberlynx: (−)-Enantiomer
- Cetalox: Racemat
Einzelnachweise
- Firmenich: Ambrox® Super, abgerufen am 2. Januar 2022.
- Eintrag zu Ambrox bei ChemBlink, abgerufen am 9. Januar 2013.
- Eintrag zu Ambroxan bei thegoodscentscompany.com, abgerufen am 17. Juni 2017.
- Datenblatt (−)-Ambroxide, ≥99% bei Sigma-Aldrich, abgerufen am 9. Januar 2013 (PDF).
- Eintrag zu Ambrox. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2022.
- G. Ohloff: The Fragrance of Ambergris. In: Ernst T. Theimer: Fragrance chemistry: the science of the sense of smell. Academic Press, New York, 1982, ISBN 0-12-685850-0.
- J.C. Leffingwell: Basic Chemical Constituents of Tobacco Leaf and Differences among Tobacco Types (PDF; 1,12 MB). In: D. Layton Davis und Mark T. Nielson (Hrsg.): Tobacco: Production, Chemistry and Technology. Blackwell Science 1999. S. 265-284. Abgerufen am 2. Januar 2022.
- Günther Ohloff: Riechstoffe und Geruchssinn. Die Molekulare Welt der Düfte. Springer-Verlag Berlin Heidelberg 1990. S. 146.
- Günther Ohloff: Riechstoffe und Geruchssinn. Die Molekulare Welt der Düfte, S. 178.
- Raffaele Tabacchi, Jean Garnero und Pierre Buil: Sur la présence d'un ester du décadiénol-2(E), 4(Z) et de diterpènes dans l'huile essentielle de cyprès (Cupressus sempervirens L.). In: Helvetica Chimica Acta, Band 58, Fasc. 4, Nr. 125, 1975. S. 1184-1187; doi:10.1002/hlca.19750580421.
- Barbara von der Lühe und andere: First evidence of terrestrial ambrein formation in human adipocere. In: Nature - Scientific Reports 9, 2019; doi:10.1038/s41598-019-54730-w.
- B. Schäfer: Chemie in unserer Zeit. 2011, 45, 374–388; doi:10.1002/ciuz.201100557.
- Patent US4970163: Process for producing diol and lactone and microorganisms capable of same. Angemeldet am 28. September 1989, veröffentlicht am 13. November 1990, Erfinder: Mohamad I. Farbood, James A. Morris, Arthur E. Downey..
- G. Ohloff, W. Giersch, W. Pickenhagen, A. Furrer und B. Frei: Significance of the geminal dimethyl group in the odor principle of Ambrox®. In: Helvetica Chimica Acta. 1985, 68, 2022–2029, doi:10.1002/hlca.19850680726.
- A. F. Barrero, E. J. Alvarez-Manzaneda, J. Altarejos, S. Salido und J. M. Ramos: Synthesis of Ambrox® from (−)-sclareol and (+)-cis-abienol. In: Tetrahedron. 1993, 49; 45, 10405–10412, doi:10.1016/S0040-4020(01)80567-6.
- H. Akita, M. Nozawa, A. Mitsuda und H. Ohsawa: A convenient synthesis of (+)-albicanol based on enzymatic function: Total syntheses of (+)-albicanyl acetate, (-)-albicanyl 3,4-dihydroxycinnamate, (-)-drimenol, (-)-drimenin and (-)-ambrox. In: Tetrahedron: Asymmetry. 2000, 11, S. 1375–1388, doi:10.1016/s0957-4166(00)00076-8.
- J. P. Kutney und C. Cirera: The chemistry of thujone. XX. New enantioselective syntheses of Ambrox and epi-Ambrox. In: Canadian Journal of Chemistry. 75 (8), 1997, S. 1136, doi:10.1139/v97-136.
- A. A. Verstqen-Haaksma, H. J. Swarts, B. J. M. Jansen und A. de Groot: Total synthesis of (−)-Ambrox® from S-(+)-carvone. In: Tetrahedron. 1994, 50; 33, 10095-10106, doi:10.1016/S0040-4020(01)89625-3.
- G. Fráter, J. A. Bajgrowicz, P. Kraft: Fragrance Chemistry. In: Tetrahedron. 1998, 54; 27, 7633–7703.
- C. Allemann: Synthesis and Application of an Electronically Chiral Mimic of CpFe. Dissertation, No. 1369, Université de Fribourg (Suisse), 2011, urn:nbn:ch:rero-002-101591.