Diterpene
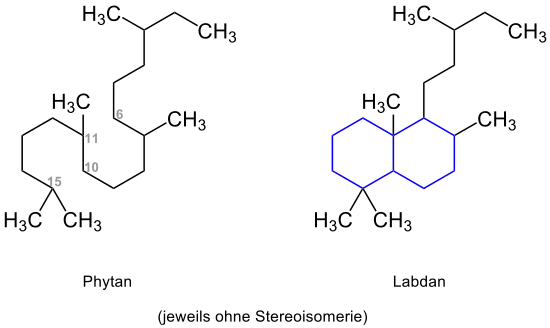
Diterpene sind aus vier Isopreneinheiten (2-Methylbutadien) aufgebaut.[1] Bei den rund 3000 bekannten natürlichen Diterpenen handelt es sich somit um Verbindungen, bestehend aus 20 Kohlenstoffatomen, die der Stoffgruppe der Terpene zuzuordnen sind.[2] Sie lassen sich in offenkettige und cyclische Verbindungen unterteilen, die sich auf das Phytan (2,6,10,14-Tetramethylhexadecan) zurückführen lassen.[1]
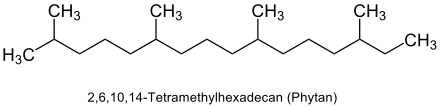
Phytane
| Verbindungsbeispiel | Nutzen/Vorkommen |
|---|---|
-Phytan.svg.png.webp) Struktur von (3R,7R,11R)-Phytan (3R,7R,11R)-Phytan[2] |
 Jürgen-Fischer-Schieferwerk-Jura-Ölschiefer Bestandteil in diversen Sedimenten, beispielsweise im Ölschiefer[2] |
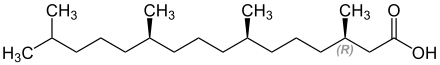 Struktur von (−)-(3R,7R,11R)-Phytansäure (−)-(3R,7R,11R)-Phytansäure[2] |
 Butter with a butter knife Spurenbestandteil in Butter[2] |
Phytan lässt sich in Form von (3R,7R,11R)-Phytan unter anderem in sedimentären Gesteinen, Ölschiefern sowie der menschlichen Leber finden.[2] Die Phytansäure kommt ebenfalls im Ölschiefer vor und lässt sich in Spuren im Butterfett nachweisen.[2][3] Phytansäure spielt im Krankheitsbild des Refsum-Syndroms eine Rolle.[3] Die Säure lagert sich hier aufgrund einer Störung des Lipoidstoffwechsels im Organfett, im Fettgewebe der Muskulatur und im Urin der betroffenen Person ab.[3] Winfried Kahlke brachte 1963 erstmals die Phytansäure mit dem Refsum-Syndrom im Rahmen der Organuntersuchung eines verstorbenen Kindes in Verbindung.[3]
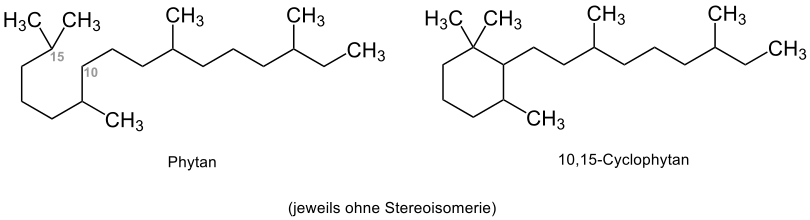
Cyclophytane
Während 1,6-Cyclophytane selten vorkommen, sind 10,15-Cyclophytane häufiger in der Natur zu finden:[4]
| Verbindungsbeispiel | Nutzen/Vorkommen |
|---|---|
 11-cis-Retinal (Vitamin A-Aldehyd) und all-trans-Retinal 11-cis-Retinal (oben) und all-trans-Retinal (unten)[4] |
 Menschliches Auge 11-cis-Retinal kommt im Rhodopsin in der Netzhaut des Auges vor[4] |
Ein Beispiel eines 10,15-Cyclophytans ist das, in Form des Vitamin-A-Aldehyds vorkommende, 11-cis-Retinal.[4] Es spielt zusammen mit dem Protein Opsin als Bestandteil des Rhodopsins in den Stäbchen der Netzhaut des Auges eine entscheidende Rolle im Rahmen der Photorezeption.[4][5]
Das Einfangen eines Photons löst im Stäbchen, genauer im Rhodopsin, die Umwandlung von 11-cis-Retinal in das stabilere all-trans-Retinal und eine Reihe weiterer chemischer Reaktionen aus.[6]
Metarhodopsin II, ein Zwischenprodukt dieser chemischen Reaktionen zieht die Desaktivierung von cGMP und damit die Schließung der (ohne Lichteinfall offenen) Natrium-Calcium-Kanäle nach sich, es wird von einer Hyperpolarisation gesprochen.[5] Eine enzymatische Reaktion desaktiviert das Metarhodopsin, so dass die Umwandlung von all-trans-Retinal in das lichtempfindlichere 11-cis-Retinal erfolgen kann.[5][6]
Bicyclophytane
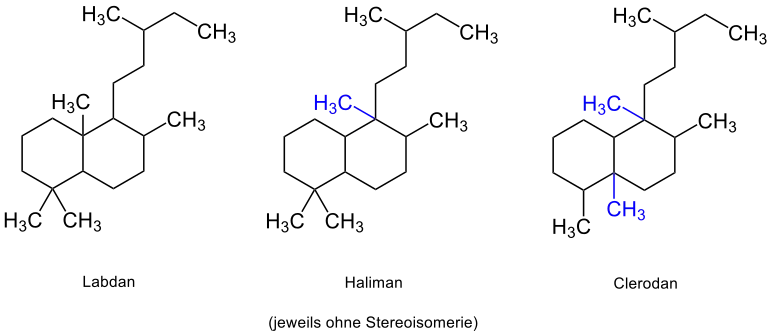
Die Bycyclophytane lassen sich auf die Grundstrukturen des Labdan, Haliman und Clerodan zurückführen. Bei den ungefähr 500 bekannten Labdanen handelt es sich um 6,11-10,15-Cyclophytane, pflanzlich vorkommende und im Bereich der Duftstoffe wichtige Verbindungen.[7] Den Strukturen liegt jeweils das bicyclische Decalin (blau markiert) zugrunde:[7]
| Verbindungsbeispiel | Nutzen/Vorkommen |
|---|---|
-14-Labden-8%252C13-diol(Sclareol).svg.png.webp) Struktur von (-)-14-Labden-8,13-diol(Sclareol) (−)-Sclareol, ein Labdan[8] |
 Salvia Sclarea, Muskatellersalbei Natürliches Vorkommen von (−)-Sclareol im Salvia sclarea, dem Muskatellersalbei[9] |
Die Namensherkunft verdanken die Labdane dem Zistrosenstrauch Cistus labdaniferus.[7] Aus den Zweigen dieses Strauchs werden beispielsweise Rohstoffe wie das Labdanumharz für die Parfümerieindustrie gewonnen.[7] Einen weiteren Parfümerierohstoff stellt das (−)-Sclareol dar, welches in der Partialsynthese des Duftstoffes Ambrox als Edukt fungiert.[7] Ambrox gilt als wichtigster Inhaltsstoff der Ambra, eine wachsartige Masse aus dem Darm des Pottwals.[9]
Umgelagerte Bicyclophytane
Durch Umlagerung von einer, beziehungsweise zwei Methylgruppen im Labdan liegt die Grundstruktur von Haliman, beziehungsweise Clerodan vor (umgelagerte Methylgruppen sind jeweils blau markiert):[7]
| Verbindungsbeispiel | Nutzen/Vorkommen |
|---|---|
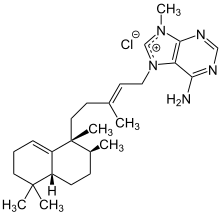 Struktur von Agelasin-B im Agelas sp. Agelasin-C, ein Haliman[10] |
Hemmende Wirkung auf die folgend dargestellte Natrium-Kalium-ATPase:  Natrium-Kalium-ATPase Natrium- und Kaliumionen werden bei Normalbedingungen unter Verbrauch von ATP durch die Membran transportiert. |
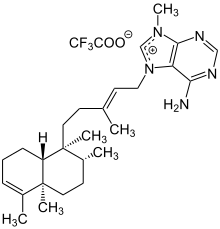 Struktur von Agelasin-B im Agelas cf. mauritiana Agelasin-B, ein Clerodan[11] |
Die Halimane verdanken ihren Namen Cistaceaen-Gewächsen wie Halimium Umbellatum.[12] Diverse Derivate finden sich zudem beispielsweise in Form von Agelasinen in den Extrakten verschiedener See-Schwämme, wie dem orangenen Okinawan sea sponge, Agelas sp.[10] Die Halimanderivate Agelasin-C und -D wirken dabei hemmend auf das Zellmembranenzym Natrium-Kalium-ATPase.[10] Eine Hemmung der Natrium-Kalium-ATPase wird therapeutisch auch durch Herzglykoside hervorgerufen.[13] Die reversibel kontrollierte Transporthemmung der Natrium- und Kaliumionen sorgt dabei für eine erhöhte Konzentration an Natrium- und infolgedessen Calciumionen innerhalb der Zelle, woraus eine positiv inotrope Wirkung resultiert.[13] Eine Überdosierung an Natrium-Kalium-ATPase-hemmenden Stoffen führt zu einem nicht kontrollierbaren Ausstoß an Calciumionen und der Nachdepolarisation der Zelle, was Arrhythmien des Herzmuskels nach sich zieht.[13] Eine ähnliche, hemmende Wirkung besitzt das Clerodanderivat Agelasin-B, welches ebenfalls aus Agelas sp sowie den Schwämmen Agelas nakamurai und Agelas cf. mauritiana isoliert werden kann.[10][11] Untersuchungen lassen auf eine Entzündungshemmende und möglicherweise Krebs-vorbeugende Wirkungsweise von Agelasin-B, bei einer Konzentration von 20 µM, schließen.[11] Mit der richtigen Dosierung wirken die Agelasine im Allgemeinen krampflösend und antibakteriell.[4]
Tricyclophytane
Über eine Cyclisierung an C-13 und C-17 des Labdan lassen sich die Pimarane und Isopimarane ableiten, wobei diese beiden Stoffe durch ihre Konfiguration an C-13 zu unterscheiden sind.[14] Durch Umgelagerungen zählen Gruppen wie die Rosane, toxische Stoffe des Pilzes Trichothecium roseum, die Cassane, Ausgangsstoff der lokalanästhetisch wirksamen Alkaloide der Cassainsäure, und die Abietane zu den Vertretern der Tricyclophytane.[14]
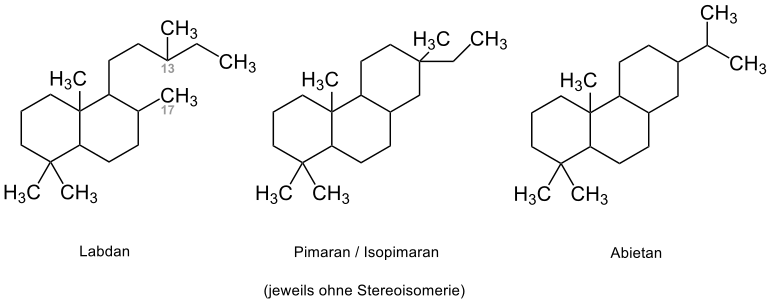
| Verbindungsbeispiel | Nutzen/Vorkommen |
|---|---|
 12α-Hydroxy-8,15-isopimaradien-18-säure 12α-Hydroxy-8,15-isopimaradien-18-säure, ein Isopimaran[15] |
 Metasequoia glyptostroboides Metasequoia glyptostroboides, ein "lebendes Fossil"[15] |
 (-)-7,13-Abietadien-18-säure (−)-Abietinsäure, ein Abietan[16][17][18] |
 Kolophonium Bestandteil des Kolophoniums[16] |
Aus Metasequoia glyptostroboides gewonnene Bestandteile, wie die 12α-Hydroxy-8,15-isopimaradien-18-säure wirken zytotoxisch auf diverse humane Tumor-Zelllinien, wie die A-549-Zelllinie.[15] Metasequoia glyptostroboides wurde erstmals 1946 von Dr. Hsen-Hsu Hu in Wan Hsien in China entdeckt und wird umgangssprachlich auch als "lebendes Fossil" bezeichnet.[15][19] Die Klassifizierung sequoia wurde 1847 von Stephanus Endlicher für Mammutbäume und verwandte Arten in Anlehnung an den Sequoyah-Stamm der Cherokee-Indianer eingeführt.[19]
Die Abietinsäure stellt den essentiellen Vertreter der Abietane dar.[16] Die Gewinnung kann per Destillation aus dem Kolophonium erfolgen.[16] Kolophonium wird dabei per Wasserdampfdestillation aus dem Balsamharz verschiedener Kiefernarten, wie der Pinus palustris gewonnen und lässt sich zum Test von allergischen Reaktionen auf bestimmte Duftstoffe nutzen.[20][21][22]
Abietinsäure erfüllt im Harz ihre Funktion als Schutzsekret vor Insekten und mikrobiellen Infektionen. Technisch findet Abietinsäure, neben der Verwendung in Lackbestandteilen, Anwendung in der Herstellung von Metallseifen und bei der Milchsäure- sowie Buttersäure-Gärung.[16][23] Zudem wird über antimikrobielle, kardiovasculäre, allergene und antiallergene Verwendungszwecke berichtet.[23]
Tetracyclophytane
Die Tetracyclophytane lassen sich im Allgemeinen vom Pimaran ableiten.[24] Zu ihnen gehören die Beyerane, Kaurane, Villanovane, Atisane, Gibberellane und Grayanotoxane.[24] Folgend werden die Grundskelette einiger dieser Vertreter aufgeführt:[24]
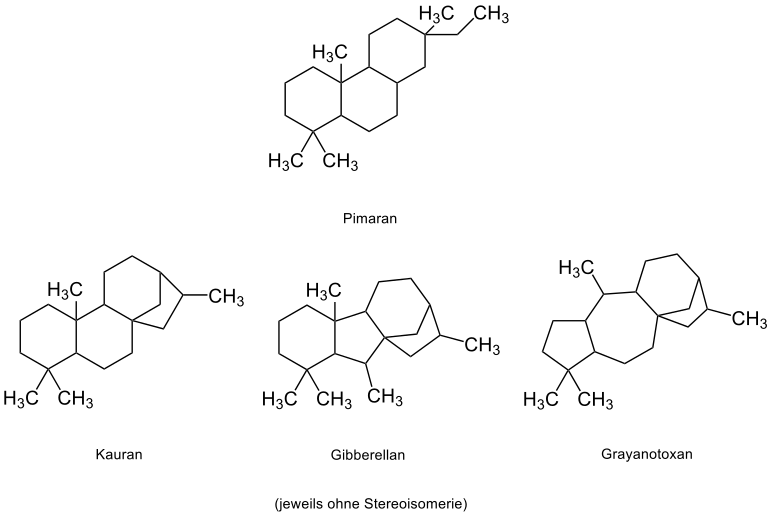
| Verbindungsbeispiel | Nutzen/Vorkommen |
|---|---|
-Cafestol_Struktur_V0.svg.png.webp) Struktur von (−)-Cafestol (−)-Cafestol, ein Kauran[24] |
 Arabica-Pflanze mit Früchten Arabica-Pflanze und Früchte |
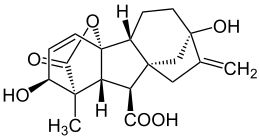 Struktur von Gibberellinsäure Gibberellinsäure, ein Gibberellan[24] |
 Erbsenpflanze Begünstigt das Wachstum junger Erbsenpflanzen.[25] |
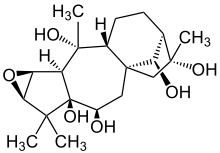 Struktur von Rhodojaponin III Rhodojaponin III, ein Grayanotoxan[24] |
 Leptinotarsa decemlineata – Kartoffelkäfer Insektizide Wirkung auf den Kartoffelkäfer.[26] |
Zu den 1.500 bekannten Kauranen zählt beispielsweise das, aus Coffea arabica gewonnene, entzündungshemmende Furanokauran (−)-Cafestol.[24] Studien belegen zudem einen Zusammenhang zwischen Kaffeekonsum und einem verringerten Risiko bezüglich kolorektalen Tumoren.[27]
Die Stevioside sind Kauranglykoside, die insbesondere aus der Pflanze Stevia rebaudiana isoliert wurden. Einige Vertreter, z. B. Steviosid sowie die Rebaudioside A, D und M, sind mehr als 150 mal so süß wie Saccharose und werden als natürliche Süßstoffe eingesetzt.
Es sind 35 Gibberellane bekannt, wobei es sich um phytohormonelle Stoffe handelt, die Einfluss auf das Pflanzenwachstum oder die Bildung von Früchten haben können.[24] Die Beeinflussung des Wachstums erfolgt dabei über eine Änderung der Ionentransporte von der Wurzel zur Sprosse.[25]
Gibberellinsäure wirkt sich positiv auf die Aufnahme von Kaliumionen in den Wurzeln und den anschließenden Transport in den Spross und damit auf das Streckungswachstum von jungen Erbsenpflanzen aus.[25]
Die Grayantoxane bilden eine Gruppe von toxischen Inhaltsstoffen in Ericaceae-Gewächsen.[24] Das Grayanotoxan Rhodojaponin III kommt in der chinesischen Rhododendronart Rhododendron molle vor und wirkt insektenfraßhemmend sowie insektizid.[28] Insektizide Wirkungen wurden gegen den, ursprünglich in Amerika heimischen und seit 1877 auf europäischem Boden vertretenen, Kartoffelkäfer Leptinotarsa decemlineata und die Heerwurmart Spodoptera frugiperda nachgewiesen.[26][29]
Weitere Vertreter der Diterpene
| Kategorie | Verbindungsbeispiel | Nutzen/Vorkommen |
|---|---|---|
| Cembrane | 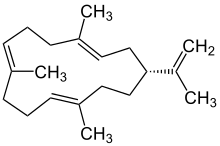 Struktur von Cembren A Cembren A, ein Cembran |
 Termiten bei den Termiten.[30] |
| Cyclocembrane | 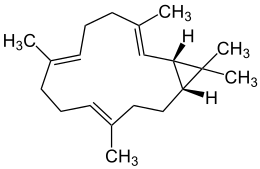 Struktur von Casben (all-trans-Casba-3,7,11-trien) Casben, ein Casban[30] |
 Ricinus communis in der Wildnis (Chimoio, Mozambique) vor Pilzbefall.[30] |
-Daphnetoxin_Struktur_V0.svg.png.webp) Struktur von (+)-Daphnetoxin (+)-Daphnetoxin, ein Daphnan[30] |
 Echter Seidelbast, Daphne mezereum |
Das Cembren A gehört zu den 100 bekannten Cembranen, wirkt bei Termiten als Pheromon und kommt in den etherischen Ölen höherer Pflanzen vor.[30][31] Zudem stellt es einen Inhaltsstoff des Weihrauchs dar.[30]
Taxane kommen nur in der Nadelbaumgattung Taxus vor und werden als Cytostatika verwendet.
Casbane sind im Allgemeinen seltene Stoffe, die jedoch in höheren Pflanzen, wie dem Euphorbiaceaen-Gewächs Ricinus communis als Schutz vor Pilzbefall fungieren, wie das Casben.[30]
Phorbole kommen in Euphorbiaceen und Thmyleaceen vor. Lipophile Derivate, insbesondere Ester mit langkettigen Fettsäuren wie das Phorbol-12-Myristat-13-Acetat oder Orthoester mit Benzoesäure wie das Daphnetoxin, welches im Seidelbast Daphne mezereum enthalten ist, rufen beim Kontakt mit Haut und Schleimhäuten starke Hautreizungen sowie allergische Reaktionen beim Menschen hervor.[30] Daphnetoxin lässt sich lediglich in Gewächsen der Thymelaeaceae finden und besitzt mitochondriale toxische Eigenschaften sowie eine eventuell krebshemmende Wirkung.[32]
Weitere Untergruppen der Diterpene bilden die Prenylsesquiterpene, bei denen das Grundskelett eines Sesquiterpens um einen Isoprenylrest ergänzt wird, und die Ginkgolide, Inhaltsstoffe des Ginkgo-Baumes.[33]
Einzelnachweise
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 2, doi:10.1002/9783527623693.
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 51, doi:10.1002/9783527623693.
- Ernst Klenk, Winfried Kahlke: Über das Vorkommen der 3.7.11.15-Tetramethyl-hexadecansäure (Phytansäure) in den Cholesterinestern und anderen Lipoidfraktionen der Organe bei einem Krankheitsfall unbekannter Genese (Verdacht auf Heredopathia atactica polyneuritiformis [Refsum-Syndrom]). In: Hoppe-Seyler’s Zeitschrift für physiologische Chemie., Band 333, 1963, S. 133–139, doi:10.1515/bchm2.1963.333.1.133.
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 52, doi:10.1002/9783527623693.
- Eberhard Betz, Dieter Mecke, Klaus Reutter, Horst Ritter: Mörike/Betz/Mergenthaler. Biologie des Menschen. 15. korrigierte Auflage, Quelle & Meyer Verlag GmbH & Co., Wiebelsheim, 2001, ISBN 3-494-01297-0, S. 564–565.
- George P. Rédei: Encyclopedia of Genetics, Genomics, Proteomics, and Informatics. Band 2 M-Z, 3. Edition, Springer, 2008, ISBN 978-1-4020-6754-9, S. 1703.
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 53, doi:10.1002/9783527623693.
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 54, doi:10.1002/9783527623693.
- Bernd Schäfer: Ambrox®. Unwiderstehliche Duftnote. In: Chemie in unserer Zeit. Nr. 45, 2011, S. 374–388, doi:10.1002/ciuz.201100557.
- Hideshi Nakamura, Houming Wu, Yasushi Ohizumi, Yoshimasa Hirata: Agelasine-A, -B, -C and -D, novel bicyclic diterpenoids with a 9-methyladeninium unit possessing inhibitory effects on na,K-atpase from the okinawa sea sponge Agelas sp. In: Tetrahedron Letters. Band 25, Nr. 28, 1984, S. 2989–2992, doi:10.1016/S0040-4039(01)81345-9.
- E. K. Ogurtsova, T. N. Makarieva, P.S. Dmitrenok, V. A. Denisenko, V. B. Krasokhin, A. S. Kuz'mich, S. N. Fedorov: ISOLATION OF AGELASIN B FROM THE MARINE FUNGUS Agelas cf. mauritiana. In: Chemistry of Natural Compounds. Band 51, Nr. 1, January, 2015, S. 189–191, doi:10.1007/s10600-015-1241-8.
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 55, doi:10.1002/9783527623693.
- Hans Marquardt, Siegfried G. Schäfer (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004, ISBN 3-8047-1777-2, S. 558–559.
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 56–58, doi:10.1002/9783527623693.
- Liao-Bin Dong, Juan He, Yuan-Yuan Wang, Xing-De Wu, Xu Deng, Zheng-Hong Pan, Gang Xu, Li-Yan Peng, Yu Zhao, Yan Li, Xun Gong, Qin-Shi Zhao: Terpenoids and Norlignans from Metasequoia glyptostroboides. In: J. Nat. Prod. 2011, Band 74, Nr. 2, S. 234–239, doi:10.1021/np100694k
- Wolfgang Steglich, Burkhard Fugmann, Susanne Lang-Fugmann (Hrsg.): RÖMPP Lexikon. Naturstoffe. 10. Auflage, Georg Thieme Verlag, Stuttgart, 1997, ISBN 3-13-749901-1, S. 1.
- Christoph Funk, Rodney Croteau: Diterpenoid Resin Acid Biosynthesis in Conifers: Characterization of Two Cytochrome P450-Dependent Monooxygenases and an Aldehyde Dehydrogenase Involved in Abietic Acid Biosynthesis. In: Archives of Biochemistry and Biophysics. 1994, Band 308, Nr. 1, S. 258–266, doi:10.1006/abbi.1994.1036
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 61, doi:10.1002/9783527623693.
- Edmund H. Fulling: Metasequoia. Fossil and Living. In: The Botanical Review. 1976, Band 42, Nr. 3, S. 215–219, JSTOR 4353902.
- Andrea Nardelli, An Carbonez, Jacques Drieghe, An Goossens: Results of patch testing with fragrance mix 1, fragrance mix 2, and their ingredients, and Myroxylon pereirae and colophonium, over a 21-year period. In: Contact Dermatitis. May 2013, Band 68, Nr. 5, S. 307–313, doi:10.1111/cod.12056
- Johanna Brared Christensson, Klaus E. Andersen, Magnus Bruze, Jeanne D. Johansen, Begona Garcia-Bravo, Ana Giménez-Arnau, Chee-Leok Goh, Rosemary Nixon, Ian R. White: An international multicentre study on the allergenic activity of air-oxidized R-limonene. In: Contact Dermatitis. April 2013, Band 68, Nr. 4, S. 214–223, doi:10.1111/cod.12036
- Wolfgang Steglich, Burkhard Fugmann, Susanne Lang-Fugmann (Hrsg.): RÖMPP Lexikon. Naturstoffe. 10. Auflage, Georg Thieme Verlag, Stuttgart, 1997, ISBN 3-13-749901-1, S. 638.
- Arturo San Feliciano, Marina Gordaliza, Miguel A. Salinero, José M. Miguel del Corral: Abietane Acids: Sources, Biological Activities, and Therapeutic Uses. In: Planta Med. 1993, Band 59 Nr. 6, S. 485–490, doi:10.1055/s-2006-959744
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 63–66, doi:10.1002/9783527623693.
- U. Lüttge, K. Bauer, D. Köhler: Frühwirkungen von Gibberellinsäure auf Membrantransporte in jungen Erbsenpflanzen. In: Biochimica et Biophysica Acta. (BBA) – Biomembranes. Band 150, Nr. 3, 1968, S. 452–459, doi:10.1016/0005-2736(68)90144-2.
- James A. Klocke, Mei-Ying Hu, Shin-Foon Chiu, Isao Kubo: Grayanoid diterpene insect antifeedants and insecticides from Rhododendron molle. In: Phytochemistry. Band 30, Nr. 6, 1991, S. 1797–1800, doi:10.1016/0031-9422(91)85015-R
- C. Cavin, D. Holzhaeuser, G. Scharf, A. Constable, W. W. Huber, B. Schilter: Cafestol and kahweol, two coffee specific diterpenes with anticarcinogenic activity. In: Food and Chemical Toxicology. Band 40, Nr. 8, 2002, S. 1155–1163, doi:10.1016/S0278-6915(02)00029-7.
- Mei-Ying Hu, James A. Klocke, Shin-Foon Chiu, Isao Kubo: Response of Five Insect Species to a Botanical Insecticide, Rhodojaponin III. In: J Econ Entomol. Band 86, Nr. 3, 1993, S. 706–711, doi:10.1093/jee/86.3.706.
- Heinz Freude, Karl Wilhelm Harde, Gustav Adolf Lohse, Wilhelm Lucht: Die Käfer Mitteleuropas: Cerambycidae, Chrysomelidae. 9. Goecke & Evers Verlag, Krefeld, 1966, ISBN 3-87263-018-0, S. 151.
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 67–75, doi:10.1002/9783527623693.
- Wolfgang Steglich, Burkhard Fugmann, Susanne Lang-Fugmann (Hrsg.): RÖMPP Lexikon. Naturstoffe. 10. Auflage, Georg Thieme Verlag, Stuttgart, 1997, ISBN 3-13-749901-1, S. 119.
- Cátia V. Diogo, Luís Félix, Sérgio Vilela, Ana Burgeiro, Inês A. Barbosa, Maria J.M. Carvalho, Paulo J. Oliveira, Francisco P. Peixoto: Mitochondrial toxicity of the phyotochemicals daphnetoxin and daphnoretin – Relevance for possible anti-cancer application. In: Toxicology in Vitro. Band 23, Nr. 5, 2009, S. 772–779, doi:10.1016/j.tiv.2009.04.002.
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 76–80, doi:10.1002/9783527623693.