Sorptionsisotherme
Eine Sorptionsisotherme beschreibt den Gleichgewichtszustand der Sorption eines Stoffes bei konstanter Temperatur.
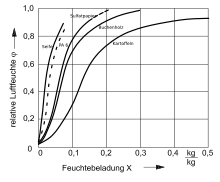
Bei Adsorption besteht für eine Substanz (das Adsorbat) ein Gleichgewicht zwischen Atomen/Molekülen die sich in einer Gasphase befinden oder in einem Lösungsmittel gelöst sind und solchen, die an einer Grenzfläche des Adsorptionsmittels (=Adsorbens) adsorbiert sind. Adsorptionsisothermen ordnen die bei konstanter Temperatur an der Oberfläche gebundene Menge des Sorbates seinem Partialdruck in der Gasphase bzw. seiner Konzentration in der Lösung zu. Adsorptionsisothermen werden experimentell durch Adsorptionsversuche ermittelt D. h., ein unbeladenes Adsorptionsmittel wird in Kontakt mit einer Gasphase oder Lösung gebracht, die das betrachtete Sorbat enthält und die adsorbierte Menge als Funktion des Partialdruckes oder der Konzentration bestimmt. Hierbei kann ein einfaches Experiment allerdings i. d. R. nicht zwischen Absorption und Adsorption unterscheiden. Bei der Ermittlung von Desorptionsisothermen wird ein beladener Sorbent mit einer unbeladenen Lösung in Kontakt gebracht. Wenn Adsorptions- und Desorptionsisothermen nicht identisch sind, spricht man von einer Hysterese der Adsorption/Desorption. Für manche praktische Zwecke ist die Kenntnis dieser experimentellen Abhängigkeit für ein spezifisches Paar aus Adsorbens und Adsorbat ausreichend.
Darüber hinaus gibt es in der Wissenschaft mehrere prominente mathematisch formulierte Adsorptionsisothermen. Die in diesen mathematisch formulierten Adsorptionsisothermen enthaltenen Parameter können aus Messdaten mittels Regressionsanalysen gewonnen werden.[1] Manche mathematisch formulierte Adsorptionsisothermen sind rein empirisch entstanden[2] und erlauben keine Aussagen über zugrunde liegende Mechanismen und Einflussgrößen. Andere hingegen basieren auf nachvollziehbaren kinetischen bzw. thermodynamischen Ableitungen; die darin enthaltenen Parameter können unter geeigneten Umständen Zustandsgrößen liefern.[3][4] Da Sorptionsisothermen mitunter die Summe mehrerer, häufig nicht mathematisch separierbarer Effekte darstellen, ist ihre Anwendbarkeit auf experimentelle Daten nicht immer gegeben. Daher finden sich in der Literatur verschiedene Adsorptionsisothermen, die jeweils unter anderen Randbedingungen anwendbar sind.
Nachfolgend werden die am häufigsten verwendeten Isothermen aufgeführt. Es existieren noch zahlreiche weitere Modelle, die oft Modifikationen der genannten Modelle sind. In den aufgeführten Beispielen wird von Adsorption aus Lösung ausgegangen und die adsorbierte Menge als Funktion der Konzentration ausgedrückt. Ist das Adsorbat hingegen ein Gas, so ersetzen wir in den Formeln die Konzentration des Adsorbates, C, durch seinen Partialdruck. Die Dimension der in den Isothermen verwendeten Parameter ändert sich dementsprechend. Die adsorbierte Menge wird meist in einer der beiden folgenden Größen angegeben.
- das Verhältnis von adsorbierter Menge zur Menge einer hypothetischen geschlossenen Monoschicht, ,
oder
- das Verhältnis von adsorbierter Menge zur Menge des Adsorptionsmittels,
ist dimensionslos, die Dimension von q richtet sich danach welche Größen wir zur Erfassung der jeweiligen Mengen verwenden. D.h. q kann dimensionslos sein oder die Dimensionen Masse/Volumen, Stoffmenge/Volumen, oder Stoffmenge/Masse haben. Man kann in q umrechnen, indem man es mit dem Produkt aus der Grenzflächenkonzentration einer geschlossenen Monoschicht des Adsorbates und der spezifischen Oberfläche des Adsorptionsmittels, , multipliziert:
In den u. a. Formeln ist als Maß für die adsorbierte Menge verwendet, in der Literatur wird jedoch mit der gleichen Berechtigung links des Gleichheitszeichens anstelle von verwendet und die Terme rechts des Gleichheitszeichens unverändert gelassen. Zahlenwerte und Dimensionen der entsprechenden Parameter ändern sich entsprechend.
Lineare Isotherme
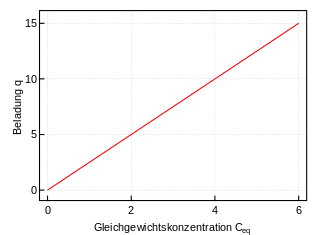
- q – Beladung des Sorbents (Masse Sorbat bezogen auf Masse Sorbent)
- KH – Henry-Koeffizient
- Ceq – Konzentration des Sorbats in Lösung
Lineare Isothermen erfreuen sich großer Beliebtheit, da sie Berechnungen stark vereinfachen. Daher werden sie häufig auch verwendet, wenn eigentlich kompliziertere Modelle verwendet werden müssten. Anwendbar sind sie zumeist nur für den Bereich niedriger Konzentrationen.
Lineare Isothermen werden besonders für die Sorption von Gasen in Flüssigkeiten auch Henry-Isothermen genannt. Siehe auch: Henry-Gesetz.
Freundlich-Isotherme

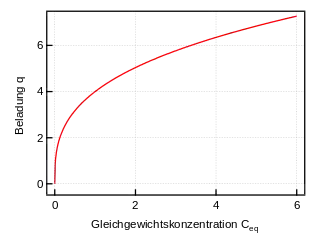
- q – Beladung des Sorbents (Masse Sorbat bezogen auf Masse Sorbent)
- KF – Freundlich-Koeffizient
- Ceq – Konzentration des Sorbats in Lösung
- n – Freundlich-Exponent
Freundlich-Isothermen[6] tragen der Tatsache Rechnung, dass bei stärkerer Beladung der Sorptionsoberflächen des Sorbenten weniger Sorbat aufgenommen werden kann. Aufgrund der Zunahme der Beladung nach einem Potenzgesetz kann jedoch eine vollständige Beladung der Oberflächen nicht abgebildet werden. Dies ist praktisch für Isothermen der Fall, in dem der Sättigungsdruck des Adsorbens vergleichsweise hoch ist, oder nicht erreicht werden kann (superfluide Medien). Die Freundlich-Isotherme ist eine spezielle Form der Zeldowitsch-Isotherme.[7]
Langmuir-Isotherme
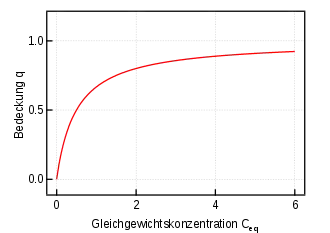
- q – Relative Bedeckung des Sorbents (Anzahl adsorbierter Teilchen bezogen auf die Anzahl von Adsorptionsplätzen)
- – der Wert, den annimmt, wenn das Adsorptionsmittel mit einer geschlossenen Monoschicht des Adsorbates bedeckt ist
- K – Langmuir-Sorptionskoeffizient
- Ceq – Konzentration des Sorbats in Lösung
Die Langmuir-Isotherme[8] [ˈlæŋmjʊə-; nach dem amerikanischen Physiker Irving Langmuir] ist das einfachste Adsorptionsmodell, das die vollständige Adsorption auf einer Oberfläche beschreibt.[2] Es werden die Annahmen getroffen, dass
- Adsorption in einer einzelnen molekularen Schicht stattfindet,
- alle Sorptionsplätze gleichwertig sind und die Oberfläche gleichförmig ist,
- es keine Wechselwirkungen zwischen benachbarten Sorptionsplätzen und den adsorbierten Teilchen gibt.
Frumkin-Isotherme
Brunauer-Emmett-Teller(BET)-Modell
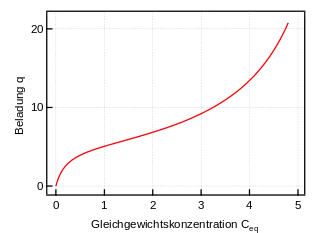
- q – Beladung des Sorbents (Masse Sorbat bezogen auf Masse Sorbent)
- K – Sorptionskoeffizient
- – der Wert, den annimmt, wenn das Adsorptionsmittel mit einer geschlossenen Monoschicht bedeckt ist
- Ceq – Konzentration des Sorbats in Lösung
- Csat – Löslichkeit des Sorbats
Das BET-Modell[9] [nach Stephen Brunauer, Paul Hugh Emmett und Edward (Ede) Teller] erweitert die Langmuir-Isotherme um das Verhalten bei hoher Konzentration des Sorbats nahe der Löslichkeit bzw. Sättigungskonzentration. Grundlage des Modells ist die Annahme, dass eine Adsorptionsstelle mehrere, bis zu unendlich viele Moleküle binden kann. Die Beladung kann daher ins Unendliche steigen. Das Modell findet bei der BET-Messung in der Oberflächenchemie Anwendung.
Weitere Modelle
Weitere bekannte Modelle zur Beschreibung des Gleichgewichts von Adsorption und Desorption sind das auf der Potentialtheorie[10] beruhende Modell von Dubinin[11] bzw. Dubinin und Raduschkewitsch, die Toth-Isotherme, die sich im einfachsten Fall in die Langmuir-Isotherme überführen lässt, sowie das Modell von Talu und Meunier, mit dem beispielsweise die Adsorption von Wasser an Aktivkohle beschrieben werden kann.[12]
Herleitung der Langmuir-Isotherme
Auf der Oberfläche sei eine bestimmte Anzahl an Bindungsstellen vorhanden. Wir nehmen an, dass jede dieser Bindungsstellen entweder mit keinem Molekül oder mit einem Molekül belegt sein kann.
Es sei
- = die Gesamtoberfläche des Adsorptionsmittels
- = die belegte Oberfläche des Adsorptionsmittels
- = die nicht belegte Oberfläche des Adsorptionsmittels
- = die Grenzflächenkonzentration der adsorbierten Moleküle, wenn diese eine geschlossene Monoschicht bilden
- = die Grenzflächenkonzentration der adsorbierten Moleküle,
- = die Grenzflächenkonzentration der freien Bindungsstellen
- = der Partialdruck der adsorbierenden gasförmigen Substanz
- = das Verhältnis der nicht belegten Oberfläche zur Gesamtoberfläche
- = das Verhältnis der Zahl der freien Bindungsstellen Moleküle zur Gesamtzahl der Bindungsstellen
- = das Verhältnis der belegten Oberfläche zur Gesamtoberfläche
- = das Verhältnis der Zahl der Bindungsstellen, an denen genau ein Molekül gebunden ist zur Gesamtzahl der Bindungsstellen.
- = das Verhältnis der Gesamtzahl der gebundenen Moleküle zur Gesamtzahl der Bindungsstellen.
- = das Verhältnis der Menge an adsorbierten Molekülen zur Menge an Molekülen in einer geschlossenen Monoschicht.
Aus der Flächenbilanz ergibt sich:
Aus der Mengenbilanz ergibt sich:
Im Rahmen der Langmuir Adsorptionsisotherme kann Werte zwischen 0 und 1 annehmen.
Wir beschreiben das Adsorptionsgleichgewicht mittels des Massenwirkungsgesetzes:
und lösen nach auf:
Interessiert das Verhältnis von Menge des Adsorbates zur Menge an Adsorptionsmittel, , so müssen wir o. g. Gleichung mit dem Produkt aus und der spezifischen Oberfläche, , multiplizieren
mit:
In der Praxis wird häufig aus experimentellen Adsorptionsisothermen durch Parameteranpassung und ermittelt und auf die Bestimmung von und verzichtet.
Betrachten wir eine Adsorption aus einer Lösung, so ersetzten wir den in o. g. Gleichung den Partialdruck, , durch die Konzentration der adsorbierenden Substanz in der Lösung, . Dementsprechend ändert sich auch die Dimension der Gleichgewichtskonstante
Herleitung der Frumkin-Isotherme
Im Gegensatz zur vorherigen Ableitung gehen wir davon aus, dass die Bindungskonstante von abhängt und sich durch folgende Funktion beschreiben lässt: durch entsprechende Substitution in die Langmuir-Isotherme erhalten wir:
Herleitung der Brunauer-Emmett-Teller (BET) – Isotherme
Im Gegensatz zur Langmuir-Isotherme nehmen wir an, dass eine jede Bindungsstelle beliebig viele Moleküle binden kann. Es sei:
- = die Zahl der an eine Bindungsstelle gebundenen Moleküle
- = das Verhältnis der Zahl der Bindungsstellen an die genau Moleküle gebunden sind zur Gesamtzahl der Bindungsstellen.
Wir beschreiben das Adsorptionsgleichgewicht mit dem Massenwirkungsgesetz Für die Bindung des ersten Moleküls postulieren wir eine Bindungskonstante . Die Bindungskonstante für weiterer Moleküle, sei von verschieden und nicht davon abhängig, wie viele Moleküle gebunden sind
- Für :
Somit ergibt sich:
Aus der Flächenbilanz ergibt sich:
und somit
Unter Kenntnis der Lösungsformel für die geometrische Reihe
Erhalten wir
Aus der Mengenbilanz ergibt sich:
und somit
Die im letzten Term enthaltene Reihe können wir auf die geometrische Reihe abbilden:
und erhalten
Kombinieren wie Mengen- und Flächenbilanz, erhalten wir :
Diese Gleichung geht für in die Langmuir Adsorptionsisotherme über. Die oben stehende Gleichung hat bei eine Polstelle. Dies bedeutete
- Nähert sich der Druck dem Wert so wird die adsorbierte Menge unendlich hoch. D.h. Im Rahmen der Langmuir Adsorptionsisotherme kann Werte zwischen 0 und 1 annehmen.
- Werte von > sind nicht sinnvoll.
- Man kann dem Gleichgewichtsdampfdruck einer kondensierten 3-dimensionalen Phase aus der adsorbierenden Substanz, , gleichsetzen.
Üblicherweise wird die BET-Isotherme in der folgenden Form geschrieben :
- mit: und
Interessiert uns das Verhältnis von Menge des Adsorbates zur Menge an Adsorptionsmittel, , so müssen wir o. g. Gleichung mit dem Produkt aus und der spezifischen Oberfläche, , multiplizieren
In der Praxis wird häufig aus experimentellen Adsorptionsisothermen durch Parameteranpassung und ermittelt und unter Verwendung von anerkannten Werten für des verwendeten Gases die spezifische Oberfläche des Adsorptionsmittels ermittelt. Hierzu wird auch oft die folgende Umstellung der o. g. Gleichung verwendet:
Trägt man gegen auf und extrapoliert gegen -> 0, so erhält man
,
.
und
.
Daraus errechnet sich
Betrachten wir nicht eine Adsorption aus der Gasphase, sondern aus einer Lösung, ersetzten wir den Partialdruck, , durch die Konzentration der adsorbierenden Substanz in der Lösung, und den Sättigungsdampfdruck, durch die Sättigungskonzentration .
Weblinks
- Video: Adsorption nach LANGMUIR, FREUNDLICH und BET – Wie wertet man Adsorptions-Isothermen aus?. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15686.
Einzelnachweise
- OECD Guidelines for the Testing of Chemicals / Section 1: Physical-Chemical properties, Test No. 106: Adsorption – Desorption Using a Batch Equilibrium Method, OECD Publishing, 2000, ISBN 978-92-64-06960-2, doi:10.1787/9789264069602-en.
- P. W. Atkins: Physical Chemistry. Oxford University Press, 6. Auflage, 1998, ISBN 0-19-850101-3.
- S. J. Gregg, K. S. W. Sing: Adsorption, Surface Area and Porosity. Academic Press, London and New York, 1967
- D. M. Young, A. D. Crowellm D. M. Young: Physical Adsorption of Gases. Butterworths, London 1962.
- Deutsche Verein des Gas- und Wasserfaches e.V. (Hrsg.): DVGW Arbeitsblatt W 239.
- Herbert Freundlich: Über die Adsorption in Lösungen. In: Zeitschrift für Physikalische Chemie. 57U, Nr. 1, 1907, S. 385–470, doi:10.1515/zpch-1907-5723.
- J. Zeldowitsch: Adsorption site energy distribution. In: Acta Physikochim, UdSSR. Nr. 1, 1934, S. 961–973.
- Irving Langmuir: Surface Chemistry. Nobel Lecture, December 14, 1932. In: Nobel Lectures, Chemistry 1922–1941. Elsevier Publishing Company, Amsterdam, 1966 (PDF auf nobelprize.org).
- S. Brunauer, P. H. Emmett, E. Teller: Adsorption of Gases on Multimolecular Layers. In: J.Am.Chem.Soc. 60, Nr. 2, 1938, S. 309–319 (PDF-Datei (Memento des Originals vom 9. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.).
- M. M. Dubinin: The Potential Theory of Adsorption of Gases and Vapors for Adsorbents with Energetically Nonuniform Surfaces. In: Chemical Reviews. Band 60, Nr. 2, 1960, S. 235–241, doi:10.1021/cr60204a006.
- Harald Jüntgen: Grundlagen der Adsorption. Staub – Reinhalt. Luft, ISSN 0949-8036, 36 (1976) Nr. 7, S. 281–288
- VDI 3674:2013-04 Abgasreinigung durch Adsorption; Prozessgas- und Abgasreinigung (Waste gas cleaning by adsorption; Process gas and waste gas cleaning). Beuth Verlag, Berlin, S. 6