Physisorption
Die Physisorption ist eine Form der Adsorption, bei der ein adsorbiertes Molekül durch Van-der-Waals-Kräfte auf einem Substrat gebunden wird – im Unterschied zur Chemisorption, bei der Adsorptionsenthalpien in der Größenordnung von chemischen Bindungsenthalpien auftreten.
Eigenschaften
Die bei Physisorption wirkenden elektrostatischen Kräfte sind schwächer als die elektrostatischen Kräfte bei chemischen Bindungen. In der Regel sind die Bindungsenergien der Physisorption im Bereich von 4 bis 40 kJ/mol. Eine Form solcher Kräfte sind die Van-der-Waals-Kräfte, also die elektrostatische Wechselwirkung zwischen induzierten, fluktuierenden Dipolen. Genauer spricht man hier von London'schen Dispersionskräften. Da die Elektronen im Molekül nicht fixiert sind, entsteht durch Schwankungen ihrer Verteilung ein temporäres Dipolmoment, dessen zeitlicher Mittelwert jedoch Null ist. Trotz seiner Kurzlebigkeit kann dieses temporäre Dipolmoment in einem benachbarten Molekül ein antiparalleles Dipolmoment induzieren, wobei die wirkenden Kräfte umgekehrt proportional zur sechsten Potenz des Abstands r sind (1/r6).
Abhängig von der Adsorbat-Adsorbens-Kombination sind jedoch auch größere Bindungsenergien möglich. Wesentlich stärkere Kräfte entstehen durch die Wechselwirkung mit den festen Dipolen an polaren Oberflächen (Salze) oder den Spiegelladungen, wie sie in elektrisch leitfähigen Oberflächen (Metallen) auftreten. Diese Wechselwirkungen sind aber schon so stark, dass sie teilweise als Chemisorption angesehen werden müssen.
Die wichtigste Eigenschaft der Physisorption (im Gegensatz zur Chemisorption) ist die geringe Veränderung des Adsorbats und Adsorbens. Bis auf Relaxationen des Substrat-Gitters finden keine Veränderungen des Adsorbens statt. Im Adsorbat werden lediglich die Bindungen leicht verändert, was sich in veränderten Schwingungsfrequenzen bemerkbar macht.
Da sich die chemischen Strukturen des physisorbierten Stoffes nicht wesentlich verändert, ist dieser Prozess prinzipiell reversibel. Da in der Regel keine Aktivierungsenergie zu überwinden ist, verläuft die Bedeckung des Adsorbens sehr rasch. Oberflächen von Festkörpern sind daher an Luft immer mit einer dünnen Schicht aus adsorbierten Stoffen bedeckt. Dies verhindert üblicherweise die Kaltverschweißung von Metallflächen.
Der direkte Übergang eines Adsorbats von der schwachen Van-der-Waals-Bindung in der Physisorption zur Ausbildung einer chemischen Bindung wurde mit Hilfe der Rasterkraftmikroskopie nachgewiesen.[1]
Vroman-Effekt
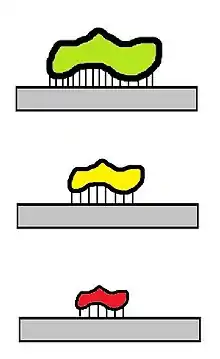
Der Vroman-Effekt wurde erstmals von Leo Vroman anhand der Bindung von Plasmaproteinen beschrieben.[2] Der Effekt umfasst die aufeinanderfolgende Anlagerung in Mischungen von Proteinen unterschiedlicher Molmasse bzw. Kettenlänge. Er fand, dass die Plasmaproteine Albumin, Globulin, Fibrinogen, Fibronectin, Faktor XII und Kininogene nacheinander adsorbiert werden.
Kleine Moleküle mit einer geringen Molmasse diffundieren schneller und binden zuerst an eine Oberfläche, sie sind kinetisch begünstigt. Größere Moleküle besitzen eine höhere Bindungsenergie, wodurch ein Austausch kleiner gegen große Moleküle einsetzt. Im Gleichgewicht sind vor allem größere Moleküle adsorbiert.
Anwendungen
Technisch macht man sich die schnelle Adsorption von Gasen an frischen, unbedeckten Oberflächen in Sorptionspumpen und Getterpumpen zunutze. Elektronenröhren haben, um das in ihnen notwendige Vakuum aufrechtzuerhalten, häufig eine Getterschicht aus aufgedampftem Titan. Die Titanoberfläche bleibt frisch und wirksam, solange die Röhre unbeschädigt ist.
Eine weitere Anwendung der Physisorption ist die Luft- oder Wasserreinigung mit Hilfe von Aktivkohle.
Literatur
- Andrew Zangwill: Physics at surfaces, Cambridge University Press 1988, ISBN 0-521-34752-1
Einzelnachweise
- Ferdinand Huber, Julian Berwanger, Svitlana Polesya, Sergiy Mankovsky, Hubert Ebert: Chemical bond formation showing a transition from physisorption to chemisorption. In: Science. 12. September 2019, ISSN 0036-8075, S. eaay3444, doi:10.1126/science.aay3444 (sciencemag.org [abgerufen am 18. September 2019]).
- Vroman, L., Adams, A. L., Fischer, G. C., Munoz, P. C.: Interaction of high molecular weight kininogen, factor XII, and fibrinogen in plasma at interfaces. In: Blood. 55, Nr. 1, 1980, S. 156–9. PMID 7350935.