Abhängigkeit von psychoaktiven Substanzen
Mit Abhängigkeit von psychoaktiven Substanzen bezeichnet man eine Gruppe von gesundheitlichen Beeinträchtigungen aufgrund wiederholter Einnahme verschiedener psychotroper Substanzen. Als typisch gilt ein starkes, periodisch oder dauerhaft auftretendes Substanzverlangen. Es kann zu einer – ggf. auch fortschreitenden – Vernachlässigung anderer Verpflichtungen oder Aktivitäten kommen. Auch ein möglicher Kontrollverlust mit zwanghaftem Substanzkonsum ist nicht ausgeschlossen.
| Klassifikation nach ICD-10 | |
|---|---|
| F10.2 | Psychische und Verhaltensstörungen durch Alkohol (Abhängigkeitssyndrom) |
| F11.2 | Psychische und Verhaltensstörungen durch Opioide (Abhängigkeitssyndrom) |
| F12.2 | Psychische und Verhaltensstörungen durch Cannabinoide (Abhängigkeitssyndrom) |
| F13.2 | Psychische und Verhaltensstörungen durch Sedativa oder Hypnotika (Abhängigkeitssyndrom) |
| F14.2 | Psychische und Verhaltensstörungen durch Kokain (Abhängigkeitssyndrom) |
| F15.2 | Psychische und Verhaltensstörungen durch andere Stimulanzien, einschließlich Koffein (Abhängigkeitssyndrom) |
| F16.2 | Psychische und Verhaltensstörungen durch Halluzinogene (Abhängigkeitssyndrom) |
| F17.2 | Psychische und Verhaltensstörungen durch Tabak (Abhängigkeitssyndrom) |
| F18.2 | Psychische und Verhaltensstörungen durch flüchtige Lösungsmittel (Abhängigkeitssyndrom) |
| F19.2 | Psychische und Verhaltensstörungen durch multiplen Substanzgebrauch und Konsum anderer psychotroper Substanzen (Abhängigkeitssyndrom) |
| ICD-10 online (WHO-Version 2019) | |

Je nach Substanz unterschiedlich stark ausgeprägt kann es zu Toleranzerhöhung und Dosissteigerung und – bei Nichteinnahme – zu Entzugserscheinungen kommen. Wenn psychoaktive Substanzen innerhalb eines sozialen Zusammenhanges eingenommen werden, ist die Abhängigkeit im Kontext komplexer Wechselwirkungen sozialer und biologischer Prozesse zu betrachten. Die Abhängigkeit von illegalen Substanzen wird umgangssprachlich auch als Drogenabhängigkeit oder Drogensucht bezeichnet.
Medizinische Definition
Nach den Definitionen der Weltgesundheitsorganisation (WHO) – siehe Kasten oben rechts: Klassifikation nach ICD-10 – besteht Abhängigkeit typischerweise durch ein starkes Verlangen, eine Substanz einzunehmen, durch Schwierigkeiten, den Gebrauch zu kontrollieren, und durch fortgesetzten Gebrauch trotz schädlicher Folgen.
Häufigkeit
Zur Häufigkeit der einzelnen Abhängigkeitssyndrome siehe jeweilige Hauptartikel zu den psychotropen Substanzen.
Auf der Grundlage wissenschaftlicher Studien wird die Zahl der manifest von Medikamenten abhängigen Menschen in Deutschland auf ca. 1,4–1,9 Millionen geschätzt. In etwa 80 % der Fälle handelt es sich dabei um eine Abhängigkeit von Benzodiazepinen,[1] die ein hohes Abhängigkeitspotential aufweisen.
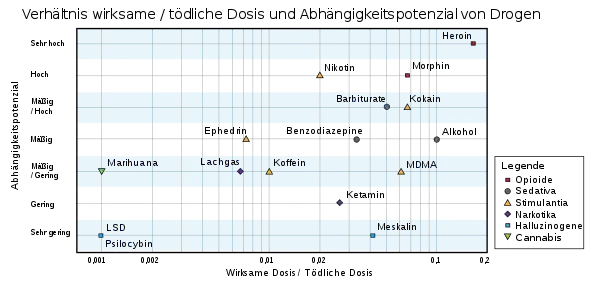
Abhängigkeitspotenzial
_de.svg.png.webp)
Psychotrope Substanzen, also Denken und Gefühle beeinflussende Stoffe, können mit jeweils unterschiedlichen Potenzialen eine Person zum unbedingten erneuten Konsum veranlassen, also zur Abhängigkeit führen. Diese Eigenschaft heißt Abhängigkeitspotenzial oder Suchtpotenzial.
Das Abhängigkeitspotenzial von Substanzen mit sehr kurzer oder sehr langer Halbwertszeit soll, nach einer Theorie von Hollister (1978), niedriger sein. Es wird angenommen, dass bei schnell anflutenden Substanzen das Abhängigkeitspotenzial am höchsten ist.[5]
Studie von 2007
Gemäß einer britischen Studie aus dem Jahr 2007 gelten als die Substanzen mit dem höchsten Abhängigkeitspotenzial (in nach Abhängigkeitspotential absteigender Reihenfolge, Skalenwerte in Klammern dahinter):[2][6]
- Das Opioid Heroin (3,00),
- das Stimulans Kokain (2,39),
- Tabak (2,21),
- das Opioid Methadon (2,08),
- und Schlafmittel aus der Gruppe der Barbiturate (2,01).
Substanzen mit mittlerem Abhängigkeitspotenzial:[2][7]
- Alkohol (1,93),
- Benzodiazepine (angstlösende Stoffe, Schlafmittel) (1,83),
- das Stimulans Amphetamin (1,67),
- das Opioid Buprenorphin (1,64),
- Ketamin (1,54),
- und Cannabis (siehe auch: Marihuana, Haschisch, Haschischöl) (1,51).
Substanzen mit niedrigem Abhängigkeitspotenzial:[2][8]
- 4-MTA (Ecstasy-ähnlich, Drogenszenenname Flatliners) (1,30),
- Methylphenidat (bekannt als Ritalin) (1,25),
- LSD (1,23),
- GHB (1,19),
- Ecstasy (1,13),
- Khat (1,04),
- und Schnüffelstoffe (1,01).
Substanzen ohne ausgeprägtes Abhängigkeitspotenzial:[2][9]
- anabole Steroide (Anabolika) (0,88),
- und Poppers (0,87).
Studie von 2017
Eine zum Teil abweichende Reihenfolge veröffentlichte 2017 die Weltkommission für Drogenpolitik.[10]
11,6 % derjenigen, die Drogen nehmen, werden im Durchschnitt abhängig:
- 32 % bei Tabak
- 23 % bei Heroin
- 17 % bei Kokain
- 15 % bei Alkohol
- 9 % bei Cannabis.
Näheres zu einzelnen Substanzen
- Alkohol
- Obwohl alkoholische Getränke in vielen Ländern legal sind, hat Ethanol ein mit Opiaten, Barbituraten und Kokain vergleichbares Abhängigkeitspotenzial. Die Alkoholabhängigkeit entwickelt sich nach einem langzeitig erhöhten Alkoholkonsum und führt zur Alkoholkrankheit.[11] Beim Absetzen der Substanz kann es zum Delirium tremens kommen. Die Zahl der Alkoholabhängigen ist hoch, weil Alkohol eine billige und einfach beschaffbare Droge ist, die zudem gesellschaftlich anerkannt ist, z. B. der Konsum bei gesellschaftlichen Anlässen.
- Amphetamine (Speed)
- Amphetamine können eine starke psychische Abhängigkeit auslösen, da die Wirkung eine gesteigerte Leistung, verbesserte Konzentration sowie Euphorie als Partydroge verspricht. Das Abhängigkeitsrisiko hängt von der genetischen Disposition sowie der psychischen Situation der Person ab. Bei Tierversuchen konnten einige Individuen ihren Konsum lebenslang regulieren, während bei 50 % nach einiger Zeit eine psychische Abhängigkeit mit starker Toleranzbildung auftrat.[12]
- Cannabis
- Die Wahrscheinlichkeit einer Abhängigkeit durch Cannabiskonsum wird durch eine Reihe psychosozialer Faktoren erhöht.[13] Die Entwicklung eines Abhängigkeitssyndroms wurde einer experimentell beobachteten Unterfunktion des Belohnungssystems im menschlichen Gehirn zugeordnet.[14][15][16]
- Halluzinogene
- Die Halluzinogene werden in verschiedene Kategorien eingeteilt. Psychedelika wie LSD, Mescalin, halluzinogene Pilze verursachen meist keine Abhängigkeit.[17][18] Halluzinogene aus der Gruppe der Dissoziativa, wie Ketamin, verursachen hingegen Abhängigkeit.[17][19][20]
- Heroin und sonstige Opiate/Opioide
- Heroin zählt zu den Substanzen mit dem höchsten Abhängigkeitspotenzial überhaupt. Aufgrund der euphorischen Wirkung bildet sich schnell eine psychische Abhängigkeit, da der Konsument im Rausch negative Gedanken und Sorgen vergisst. Das Abhängigkeitsrisiko wird demnach nach der psychosozialen Situation des Konsumenten bestimmt. Nach häufigem Gebrauch stellt sich bei Opiaten eine Abhängigkeit ein, wobei der Entzug als äußerst unangenehm erlebt wird und daher für den Betroffenen eine (negative) Motivation bietet, weiter zu konsumieren, um die Entzugserscheinungen zu vermeiden oder zu reduzieren.
- Kokain und Crack
- Das Abhängigkeitspotenzial von Kokain gilt ebenfalls als sehr hoch. Bis 1980 herrschte die Auffassung vor, Kokain verursache keine Abhängigkeit im Sinne von Entzugserscheinungen. Wenige Jahre später schlug diese Auffassung in ihr Gegenteil um, unter anderem nachdem entsprechende Veränderungen im Gehirn bekannt geworden waren.[21] Seit den 1990er Jahren sind psychische Entzugssyndrome durch Kokaingebrauch wissenschaftlich etabliert,[22][23][24] und zunehmend auch auf biochemischer Ebene erforscht.[25][26] Die aus Kokain hergestellte Droge Crack verursacht im Vergleich eine noch stärkere Abhängigkeit, und das teilweise bereits nach recht kurzer Konsumzeit.[27]
- Medikamente
- Etwa 4 bis 5 % der Medikamente besitzen ein Missbrauchs- oder Abhängigkeitspotenzial.[1] Das trifft insbesondere für Hypnotika, Sedativa und Tranquillantien sowie für Psychostimulantien zu, außerdem für opioidhaltige Analgetika. Patienten erwarten von Medikamenten meist eine positive Wirkung, daher kann es unter Umständen schwer sein, das Gefahrenpotenzial hinsichtlich eines Missbrauches oder einer Abhängigkeit bei der Einnahme richtig einzuschätzen.
- MDMA (Ecstasy)
- Die Abhängigkeitsrate gewöhnlicher MDMA-Konsumenten nach den Kriterien von DSM IV wurde in einer systematischen Übersichtsarbeit von 2011 auf ca. 15 % geschätzt.[28] Langandauernde Schäden (länger als 2 Jahre) an Nervenendigungen, die mit Dopamin oder Serotonin arbeiten, sind dagegen auch beim Menschen eine generelle Erscheinung, die also alle Konsumenten betrifft.[29]
- Tabakrauch
- Für die Abhängigkeit nach Tabakrauch ist Nikotin mitverantwortlich.[30][31] Vergleiche von Tierstudien und Studien über menschlichen Drogenkonsum zeigen auf, dass pures Nikotin nur wenig Abhängigkeitspotenzial hat, Tabakzigarettenrauch jedoch ein sehr hohes Suchtpotenzial aufweist.[32][33][34] Nikotin hat in Verbindung mit anderen Stoffen im Tabakrauch ein extrem hohes Abhängigkeitspotenzial und kann sehr schnell zu einem abhängigen Verhalten führen.[35] Laut einem im Jahr 2007 veröffentlichten Papier von D. Nutt u. a. liegt das Abhängigkeitspotenzial von Tabakrauch zwischen Alkohol und Kokain. Genauer gesagt, liegt das physische Abhängigkeitspotential bei dem von Alkohol bzw. Barbituraten und das psychische Abhängigkeitspotenzial bei dem von Kokain.[36] Ein Vergleich mit der Abhängigkeit von Opiaten wie Heroin ist nicht angezeigt, weil diese weitaus komplizierter zu behandeln ist und die Entzugserscheinungen schwerwiegender sind. Es reichen wenige Zigaretten oder wenige Tage mit kleinem Zigarettenkonsum bis zum Eintritt der Abhängigkeit. Das Abhängigkeitspotenzial von oral aufgenommenem Nikotin ist deutlich geringer, Pflaster haben fast kein Abhängigkeitspotenzial.[37]
- Vor allem ist von Bedeutung, dass Nikotin, in Verbindung mit anderen Stoffen im Tabakrauch, unterschwellig das Verlangen nach einem Tabakerzeugnis erzeugt und durch das immer kürzer werdende gewöhnungsbedingte Reiz-Reaktions-Intervall eine immer stärker ausgeprägte Abhängigkeit in Form von erhöhtem Tabakkonsum entsteht.
- Man weiß heute, dass bereits nach drei Wochen Abstinenz keine messbare Veränderung der Acetylcholinrezeptoren mehr vorhanden ist – diese sich also wieder auf Normal-Niveau eingestellt haben. Während dieser Zeit kann es zu Unruhe und Gereiztheit bis hin zu Aggressivität sowie zu Depressionen kommen. Das Nikotin selbst ist zu diesem Zeitpunkt schon längst nicht mehr im Gehirn nachweisbar (bis max. drei Tage nach Beendigung des Nikotinkonsums).
- Folglich kann man ein Abhängigkeitspotential konstatieren, welches eher unbewusst, d. h. im unreflektierten Alltag, seine stärkste Ausprägung findet. In Entzugsphasen tritt es dadurch zum Vorschein, dass diese unbewussten Anteile nun bewusst durch den Entziehenden verarbeitet werden.
- Im Ergebnis ist festzustellen, dass während des Entzugs weniger die Abhängigkeit von der vom Tabakrauch erzeugten Wirkung von Bedeutung ist, was viele gescheiterte Therapien mit Nicotinsubstituten zeigen, sondern vielmehr der durch die nikotinerge Stimulation des Nucleus accumbens induzierte Lernprozess. In geeigneter Weise kann dieser Lernprozess nur durch starke Selbstmotivation oder professionelle Verhaltenstherapien beeinflusst bzw. umgekehrt werden. Nikotinersatz oder Medikamente können den Entzug unterstützen.
- Die Rückfallwahrscheinlichkeit bei Rauchern, die ohne Hilfsmittel mit dem Tabakkonsum aufhören, liegt bei 97 % innerhalb von sechs Monaten nach dem Rauchstopp. Bis 2012 ging man davon aus, dass Nikotinersatzpräparate bei korrekter Dosierung und weiterer fachlicher Anleitung die Erfolgschancen um 3 % steigern können.[38] Eine neuere Studie von 2012 besagt, dass die Rückfallraten bei denen, die Nikotinersatzpräparate zum Aufhören verwendet haben, genau so hoch war wie derer, die ohne Hilfsmittel aufgehört haben.[39][40]
- Die psychische Abhängigkeit durch eingeprägte Verhaltensmuster, die sich im Laufe einer „Raucherkarriere“ entwickeln, kann nach dem Entzug auch nach Jahren noch vorhanden sein.
Multipler Substanzgebrauch
Eine Störung durch multiplen Substanzgebrauch liegt laut ICD-10 (F19.-) vor, wenn die Substanzaufnahme chaotisch und wahllos verläuft, oder wenn Bestandteile verschiedener Substanzen untrennbar vermischt sind.
Theorien zur Entstehung des Abhängigkeitssyndroms
Abhängigkeit ist das Ergebnis eines multikausalen Prozesses, bei dem biologische und soziale Faktoren zusammenwirken.[41]
Genetische Disposition
Die Wahrscheinlichkeit einer Suchterkrankung wird auch durch bestimmte Varianten in den Erbanlagen mit beeinflusst. Allerdings gibt es bis heute (2018) immer noch eine große Lücke zwischen den im Einzelnen sehr kleinen Effekten von diesbezüglichen genetischen Abweichungen und dem bekannten Ausmaß tatsächlicher erblicher Beeinflussung.[42][43] Gleichwohl gibt es bereits sehr konkrete Ergebnisse im Bereich Nikotin,[44][45] Opioiden,[46] Alkohol,[47][48][49] Cannabis[50][51] und Kokain.[26] Untersuchungsmethoden auf diesem Gebiet sind Familienstudien, Adoptionsstudien, Zwillingsstudien, Kandidatengen-Findung, genomweite Assoziationsstudien und die Analyse von Copy Number Variants (CNV) bei bestimmten Chromosomen-Abschnitten.
Neurobiologische Wirkmechanismen
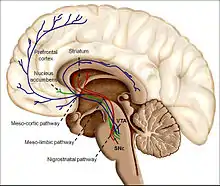
Das Entstehen einer Abhängigkeit ist neurobiologisch gesehen eine krankhafte (pathologische) Form eines eigentlich nützlichen, biologischen Lernvorgangs, der Sensitivierung genannt wird.[52] Auf den Oberflächen und im Innern von Nervenzellen bewirkt eine psychoaktive Substanz Veränderungen, die das zukünftige Verlangen nach einem erneuten Konsum dieser Substanz verstärken. Diese Sensitivierung des Verlangens hält in der Regel auch noch lange nach einem Entzug an und verursacht deshalb ein erhöhtes Risiko für einen Rückfall. Das angestrebte Gefühl (Euphorie) wird im Gegensatz zum Verlangen nicht verstärkt, sondern schwächt sich ab (Toleranzentwicklung).[53][54]
Auf zellulärer und molekularer Ebene wird die Sensitivierung durch Veränderungen in Neurochemie, Neurophysiologie, Neuroanatomie und Genexpression verursacht. Dabei kann bereits ein einmaliger Gebrauch einer Substanz zu lange anhaltenden Veränderungen in der Signalübertragung von Nervenzellen führen. Die weitreichendsten Veränderungen passieren während der Entwicklungsphasen des Gehirns, am extremsten während der vorgeburtlichen (pränatalen) Entwicklung.[17][55][56][57]
In zwei Übersichtsarbeiten (Reviews) von 2016 wird Abhängigkeit als ein Zusammenhang von drei Krankheits-Komplexen beschrieben, die jeweils bestimmten Veränderungen in bestimmten Netzwerken des Gehirns zugeordnet werden. Es sind dies die Komplexe (1) krankhaftes Verlangen (Sucht), (2) krankhafte Entzugserscheinungen und (3) krankhafte Erwartungshaltungen.[58][59] In einer nachfolgenden Übersichtsarbeit von 2018 wurde beschrieben, dass dieses Modell – mit kleinen Abweichungen – auch für den Missbrauch von Cannabis zutreffend ist.[60]
Kreuzsensitivierung von Substanzen
In vielen Untersuchungen zeigte sich, dass der wiederholte Konsum einer Substanz nicht nur die Empfindlichkeit für diese Substanz erhöhen kann (Sensitivierung), sondern auch die Empfindlichkeit für andere psychoaktive Substanzen. Diesen Vorgang bezeichnet man als Kreuzsensitivierung.[61]
In Tierversuchen kann – im Vergleich zu klinischen Studien – relativ einfach festgestellt werden, ob der Konsum einer Droge die spätere Attraktivität einer anderen Droge erhöht. Zum Beispiel erhöhte Cannabiskonsum bei Tieren die Selbstverabreichung von Heroin,[62][63][64] Morphin[65][66] und auch Nikotin[67][68][69] in Folgeexperimenten. Es wurden auch direkte Anzeichen dafür gefunden, dass der Mechanismus der Prägung in einer andauernden Veränderung des Belohnungssystems des Gehirns besteht.[62][63][64] Die Bedeutung dieser Ergebnisse für das Belohnungssystem im menschlichen Gehirn in Bezug auf die Anfälligkeit für weitere Drogen ist in mehreren Übersichtsarbeiten herausgestellt worden.[70][71][72]
Epidemiologische Ergebnisse
Denise Kandel, Professorin für soziomedizinische Wissenschaften in der Psychiatrie an der Columbia-Universität und Leiterin der Abteilung Epidemiologie von Substanzmissbrauch am New York State Psychiatric Institute, und Kollegen veröffentlichten seit 1975 die Ergebnisse mehrerer Studien zur zeitlichen Abfolge des Erstgebrauchs von Drogen. Es wurde beobachtet, dass die Reihenfolge des Erstkonsums verschiedener Drogen nicht zufällig ist, sondern Trends aufweist. Durch die etablierte Technik der Längsschnittstudie ließen sich diese Trends präzise beschreiben, und zwar durch die Angabe von Wahrscheinlichkeiten.[73][74][75][76]
Eine Metaanalyse von 2018 kam zu dem Ergebnis, dass der Gebrauch von E-Zigaretten die Wahrscheinlichkeit einer späteren Anwendung herkömmlicher Tabak-Zigaretten deutlich erhöht:
„Es liegen starke empirische Belege [Hervorhebung im Original] vor, dass der Gebrauch von E-Zigaretten bei Jugendlichen und jungen Erwachsenen das Risiko erhöht, jemals brennbare Tabakzigaretten zu verwenden.“[77]
Dies wurde von den Autoren unter anderem damit in Zusammenhang gebracht, dass die bekannte Sensitivierung des Gehirns durch das Nikotin der E-Zigaretten - insbesondere bei Heranwachsenden - zu einer erhöhten Wahrscheinlich weiteren Nikotinkonsums führt.[78][79]
Willenhafte Steuerung des Substanzverlangens
Abhängigkeit beinhaltet eine Beeinträchtigung von Wahrnehmung, Risikoabschätzung und Kontrolle des eigenen Verhaltens. Die Wahrscheinlichkeit automatischen Verhaltens im Zusammenhang mit Substanzgebrauch ist erhöht. Die Möglichkeit, zwischen verschiedenen Entscheidungen zu wählen, ist somit zwar oft erschwert, aber keineswegs vollständig verloren.[80]
Begleiterkrankungen und Folgen
Neben dem Abhängigkeitssyndrom gibt es eine Reihe von Begleitkrankheiten.
Psychische Begleiterkrankungen
Psychische Störungen können einem Abhängigkeitssyndrom vorausgehen und sind als Begleitkrankheiten zu therapieren. Mögliche Begleitkrankheiten können z. B. Angststörungen, Depression, ADHS, Anpassungsstörungen, Persönlichkeitsstörungen oder Psychosen sein. Die genannten psychischen Störungen können ebenso Folge eines Abhängigkeitssyndrom sein, im Fall einer Psychose ist der Begriff Drogenpsychose geläufig. Auch soziale Isolation kann einem Abhängigkeitssyndrom vorausgehen oder Folge davon sein.
Folgen des Abhängigkeitssyndroms
Die Folgen des Abhängigkeitssyndroms hängen wesentlich ab von der psychotropen Substanz, zu der die Abhängigkeit besteht. Siehe daher auch den Hauptartikel zur jeweiligen Substanz.
Die Orientierung auf die Sucht nimmt im Leben der Betroffenen einen immer größeren Raum ein. Die Aufmerksamkeit der Konsumierenden wird zunehmend auf Konsum und Beschaffung der psychoaktiven Substanz und das anschließende Verweilen im Rauschzustand verlagert. Andere Aktivitäten, Interessen und Verpflichtungen werden oft vernachlässigt. Die Persönlichkeit, oder die Persönlichkeitsentwicklung, kann erheblich beeinträchtigt werden. Zusätzlich besteht die Gefahr von Beschaffungskriminalität.
Prävention und Therapie
Prävention
Neuere Ansätze zur Drogenprävention setzen weniger auf Abschreckung, d. h. die Betonung der oft organismusschädigenden Eigenschaften, sondern vermehrt auf Aufklärung. Abschreckung wurde von den Zielgruppen häufig nicht ernst genommen. Aufklärung wird als eine Alternative zu der auf Repression ausgerichteten Drogenpolitik, in der der Drogenkonsum als nicht tolerabel angesehen wird, eingesetzt.
Ziel dieses Präventionskonzept ist es, Wissen um die Wirkung einer Substanz zu vermitteln. Dies betrifft sowohl die zu erwartenden angenehmen Wirkungen bzw. unerwünschten Nebenerscheinungen, als auch die möglichen sozialen und gesundheitlichen Schäden. Dieses Wissen soll es dann ermöglichen, eine eigene Entscheidung zu treffen. Da nicht davon ausgegangen wird, dass diese Entscheidung in jedem Fall gegen den Konsum ausfällt, soll zu ungefährlichem Umgang, wie beispielsweise der Vermeidung vom Mischkonsum, angeregt werden. Ziel der Prävention soll es sein, auf die Stärkung der Persönlichkeit und das Aufzeigen von Alternativen zum Substanzkonsum hinzuwirken. Diese Alternativen müssen für die potentiellen Konsumierenden erlebbar sein – beispielsweise die Erfahrung, dass man sich nach ein zwei Stunden „Auspowern“ mindestens ebenso „relaxed“ fühlt wie durch den Konsum von Cannabis.
Prävention und substanzspezifische Aufklärung soll so früh wie möglich beginnen, da der erste Kontakt mit Drogen häufig in der Adoleszenz stattfindet.[81][82]
Therapie
Eine Drogentherapie bei einem Abhängigkeitssyndrom hat den dauerhaften Verzicht (Abstinenz) auf die abhängigkeitserzeugende Substanz zum Ziel und kann folgende Punkte umfassen:
- Entzug der abhängig machenden Substanz
- Substitution durch eine Substanz ohne oder mit geringerer Schadwirkung
- psychotherapeutische Behandlung (Kurzzeitinterventionen, v. a. Langzeitentwöhnung) in einer Fachklinik, wobei diese ihr Augenmerk auf eventuelle Defizite in der Persönlichkeitsentwicklung der Patienten legen und sich stark an individuellen Möglichkeiten orientieren
- Physiotherapie
- Mitarbeit in Selbsthilfegruppe
- Mitbehandlung der Angehörigen/Bezugspersonen; siehe auch: Co-Abhängigkeit
In der Behandlung Opiatabhängiger kann die (manchmal dauerhafte) Verabreichung eines Ersatzstoffes im Rahmen einer Substitutionstherapie zu einer deutlichen Schadensbegrenzung (engl.: harm reduction) führen. Dabei wird die Forderung nach Abstinenz als alleiniges Behandlungsziel aufgegeben, bzw. jeweils im Einzelfall (und eventuell immer wieder neu) entschieden. Die Wirksamkeit einer Dauersubstitution ist überzeugend belegt und wird auch vom Gesetzgeber anerkannt.[83][84] Es werden auch Medikamente entwickelt, die nicht als Substitution zu betrachten sind, sondern die Abhängigkeitssymptome gezielt bekämpfen sollen z. B. Clofenciclan.
Die Behandlung von Abhängigkeiten hat sich zu einem Spezialgebiet der Medizin entwickelt, das heute zunehmend auch auf Erkenntnissen der Neurobiologie aufbaut und ein ganzes Spektrum an therapeutischen Verfahren anbieten kann. Auch pädagogische Maßnahmen können Teil einer Therapie sein, insbesondere bei Jugendlichen.[82]
Überholte Vorstellungen
Der Ausdruck „psychische Abhängigkeit“ hat seinen Ursprung in der Beobachtung, dass ein Abhängigkeitssyndrom manchmal in erster Linie durch negative Gefühle (Emotionen), wie Depression oder Angst, erlebt wird. Von „physischer Abhängigkeit“ sprach man in diesem Zusammenhang, wenn zusätzlich vegetative Störungen auftraten, wie Unruhe oder Kreislaufstörungen. Die Grenzen zwischen beiden Begriffen waren jedoch immer fließend, da emotionale und vegetative Effekte sich immer auch gegenseitig beeinflussen.
Seit der zunehmenden Beschreibung von Veränderungen im Gehirn im Zusammenhang mit Abhängigkeitssyndromen sind seit den 1990er Jahren durch bildgebende Verfahren[85][86][87] die Unterschiede zwischen sogenannten psychischen und physischen Effekten überflüssig geworden. Die beobachteten Veränderungen im Gehirn betreffen beide Arten von Effekten gleichermaßen. In der Wissenschaft ist die Unterscheidung seitdem nahezu ausgestorben. Der letzte in PubMed gelistete Übersichtsartikel (Review) von westlichen Autoren mit "psychological dependence" im Titel erschien 1990.[88]
Abgrenzungen
Andere Formen der Abhängigkeit, die nicht durch Konsum psychotroper Substanzen gekennzeichnet sind, sind im Artikel Abhängigkeit (Medizin) zusammengefasst. Wenn Konsum von psychoaktiven Substanzen zu einer Überschreitung von Gesetzen führt, wird Abhängigkeit oder Substanzkonsum strafrechtlich definiert. Fragestellungen dieser Art berühren dann in der Regel die Arbeitsgebiete der Toxikologie im Bereich der Rechtsmedizin.
Siehe auch
- Suchtmedizin
- Absetzen: Ausschleichung · Schlusspunktmethode
- Spezielle Substanzen: Opiatabhängigkeit · Tabakzusatzstoff · Schädlicher Gebrauch von Benzodiazepinen
- Substanzungebundene Abhängigkeit
- Süchtig – Protokoll einer Hilflosigkeit (Langzeit-Dokumentarfilm)
AWMF-Leitlinien
Leitlinien der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften:
- S3-Leitlinie: Metamphetamin-bezogene Störungen (Stand 2016)
- S3-Leitlinie: „Screening, Diagnose und Behandlung alkoholbezogener Störungen“ (Stand: 2015)
- S3-Leitlinie: „Screening, Diagnostik und Behandlung des schädlichen und abhängigen Tabakkonsums“ (Stand: 2015)
- S2-Leitlinie: Psychische und Verhaltensstörungen durch Kokain, Amphetamine, Ecstasy und Halluzinogene, AWMF-Registernummer 076/007 (online: Volltext (Memento vom 2. Januar 2005 im Internet Archive)), Stand 10/2004
- Medikamentenabhängigkeit. (Memento vom 4. Februar 2010 im Internet Archive) Uni Düsseldorf
Literatur
Allgemein
- Günter Amendt: No drugs – No future. Drogen im Zeitalter der Globalisierung. Europa-Verlag, Hamburg / Wien 2003, ISBN 3-203-75013-9.
- Klaus Behrendt, Markus Backmund, Jens Reimer (verantwortlich für den Inhalt): Drogenabhängigkeit (= Suchtmedizinische Reihe. Band 4). 4. Auflage. Deutsche Hauptstelle für Suchtfragen e. V., Hamm 2016, ISBN 978-3-937587-03-5 (dhs.de [PDF; 2,3 MB]).* Stefan Böhm: Suchtmittel. In: Michael Freissmuth u. a.: Pharmakologie und Toxikologie: Von den molekularen Grundlagen zur Pharmakotherapie. Springer, Berlin 2016, ISBN 978-3-662-46689-6., S. 327–336 (Vorschau Google Books).
- Andreas Heinz, Anil Batra, Norbert Scherbaum, Euphrosyne Gouzoulis-Mayfrank: Neurobiologie der Abhängigkeit. Grundlagen und Konsequenzen für Diagnose und Therapie von Suchterkrankungen. Kohlhammer, Stuttgart 2012, ISBN 978-3-17-021474-3.
- Steven B. Karch (Hrsg.): Addiction and the Medical Complications of Drug Abuse, CRC Press, London 2008, ISBN 978-1-4200-5444-6 (Vorschau Google Books).
- George F. Koob, Michael A. Arends, Michel Le Moal: Drugs, addiction, and the brain. Academic Press, Oxford 2014, ISBN 978-0-12-386959-3 (Vorschau Google Books).
- Victor R. Preedy: Neuropathology of Drug Addictions and Substance Misuse. Volume 1: Foundations of Understanding, Tobacco, Alcohol, Cannabinoids and Opioids. Academic Press, London 2016, ISBN 978-0-12-800376-3 (Vorschau Google Books).
- Michael Soyka u. a.: Suchtmedizin. Elsevier, München 2019, ISBN 978-3-437-17051-5. (Vorschau Google Books).
- Felix Tretter (Hrsg.): Suchtmedizin kompakt: Suchtkrankheiten in Klinik und Praxis – Griffbereit. 3., aktualisierte und erweiterte Auflage. Schattauer Verlag, Stuttgart 2017, ISBN 978-3-7945-3162-2 (Vorschau Google Books).
- Jens Ullrich: Sucht, Abhängigkeit und schädlicher Gebrauch. In: Maximilian von Heyden, Henrik Jungaberle, Tomislav Majić (Hrsg.): Handbuch Psychoaktive Substanzen. Springer, Berlin 2018, ISBN 978-3-642-55125-3, S. 207–215 (Vorschau Google Books).
Ratgeber
- Karin Elsesser, Gudrun Sartory: Ratgeber Medikamentenabhängigkeit. Informationen für Betroffene und Angehörige. Hogrefe Verlag, Göttingen 2005, ISBN 978-3-8444-1767-8 (Vorschau Google Books).
- Karl-Ludwig Täschner, Benedikt Bloching, Gerhard Bühringer, Gerhard A. Wiesbeck: Therapie der Drogenabhängigkeit. 2., vollständig überarbeitete und erweiterte Auflage. Kohlhammer Verlag, Stuttgart 2010, ISBN 978-3-17-026593-6, (Vorschau Google Books).
- Maree Teesson, Louisa Degenhardt, Wayne Hall: Suchtmittel und Abhängigkeit: Formen - Wirkung - Interventionen. Huber Verlag, Bern 2008, ISBN 978-3-456-84476-3.
Geschichte
- Claudia Wiesemann: Die heimliche Krankheit. Eine Geschichte des Suchtbegriffs. (= Medizin und Philosophie. Band 4). Frommann-Holzboog, Stuttgart 2000, ISBN 3-7728-2000-X.
- J. Olds, P. Milner: Positive reinforcement produced by electrical stimulation of septal area and other regions of rat brain. In: Journal of comparative and physiological psychology. Band 47, Nummer 6, Dezember 1954, S. 419–427, PMID 13233369.
Weblinks
- Eintrag Abhängigkeit, physische und psychische im Lexikon der Psychologie auf spektrum.de (WHO-Terminologie)
- Was ist Sucht / eine Suchterkrankung? – Neurologen und Psychiater im Netz (Terminologie und Statistik)
- Volkart Wildermuth: Das abhängige Gehirn. Neue Perspektiven für die Therapie von Suchterkrankungen. In: Wissenschaft im Brennpunkt, Deutschlandfunk, 5. März 2006
Einzelnachweise
- Medikamentenabhängigkeit. Website der Bundesärztekammer (Memento vom 16. Januar 2013 im Internet Archive)
- David Nutt, Leslie A King, William Saulsbury, Colin Blakemore: Development of a rational scale to assess the harm of drugs of potential misuse. In: The Lancet. Band 369, März 2007, S. 1047–1053, doi:10.1016/S0140-6736(07)60464-4.
- Robert Gable: Drug Toxicity. Abgerufen am 17. Februar 2011.
- R. S. Gable: Acute toxicity of drugs versus regulatory status. In J. M. Fish (Hrsg.): Drugs and Society: U.S. Public Policy. Rowman & Littlefield Publishers, Lanham MD 2005, ISBN 0-7425-4244-0, S. 149–162.
- Lutz G. Schmidt, Markus Gastpar, Peter Falkai: Evidenzbasierte Suchtmedizin: Behandlungsleitlinie substanzbezogene Störungen. Deutscher Ärzte-Verlag, 2006, ISBN 3-7691-0520-6, S. 276.
- Mittelwert Abhängigkeitspotenziale ≥ 2,00 in der Skala der Studie von Nutt u. a.
- Mittelwert Abhängigkeitspotenziale ≥ 1,50 und < 2,00 in der Skala der Studie von Nutt u. a.
- Mittelwert Abhängigkeitspotenziale ≥ 1,00 und < 1,50 in der Skala der Studie von Nutt u. a.
- Mittelwert Abhängigkeitspotenziale < 1,00 in der Skala der Studie von Nutt u. a.
- Deutschland im Rausch – Der verlorene Kampf gegen die Drogen Film von Anna Feist, ZDFzoom vom 23. Oktober 2019, in der Mediathek abrufbar bis 23. Oktober 2020, die Zahlen erscheinen ganz am Ende
- Alkohol - Das berauschende Genuss- bzw. Suchtmittel (Memento vom 3. Dezember 2013 im Internet Archive)
- Gabriel Galli, Jochen Wolffgramm: Long-term voluntary D-amphetamine consumption and behavioral predictors for subsequent D-amphetamine addiction in rats. In: Science. 73/1, 2004, S. 51–60. PMID 14687959
- S. Schlossarek, J. Kempkensteffen, J. Reimer, U. Verthein: Psychosocial Determinants of Cannabis Dependence: A Systematic Review of the Literature. In: European addiction research. Band 22, Nummer 3, 2016, S. 131–144, doi:10.1159/000441777, PMID 26551358 (freier Volltext) (Review).
- Z. D. Cooper, M. Haney: Actions of delta-9-tetrahydrocannabinol in cannabis: relation to use, abuse, dependence. In: International Review of Psychiatry. Band 21, Nummer 2, April 2009, S. 104–112, doi:10.1080/09540260902782752, PMID 19367504, PMC 2731700 (freier Volltext) (Review).
- E. van de Giessen, J. J. Weinstein, C. M. Cassidy, M. Haney, Z. Dong, R. Ghazzaoui, N. Ojeil, L. S. Kegeles, X. Xu, N. P. Vadhan, N. D. Volkow, M. Slifstein, A. Abi-Dargham: Deficits in striatal dopamine release in cannabis dependence. In: Molecular Psychiatry. Band 22, Nummer 1, 01 2017, S. 68–75, doi:10.1038/mp.2016.21, PMID 27001613, PMC 5033654 (freier Volltext).
- M. A. Bloomfield, A. H. Ashok, N. D. Volkow, O. D. Howes: The effects of Δ-tetrahydrocannabinol on the dopamine system. In: Nature. Band 539, Nummer 7629, 11 2016, S. 369–377, doi:10.1038/nature20153, PMID 27853201, PMC 5123717 (freier Volltext) (Review).
- E. R. Korpi, B. den Hollander, U. Farooq, E. Vashchinkina, R. Rajkumar, D. J. Nutt, P. Hyytiä, G. S. Dawe: Mechanisms of Action and Persistent Neuroplasticity by Drugs of Abuse. In: Pharmacological Reviews. Band 67, Nummer 4, Oktober 2015, S. 872–1004, doi:10.1124/pr.115.010967, PMID 26403687 (freier Volltext) (Review).
- D. De Gregorio, S. Comai, L. Posa, G. Gobbi: d-Lysergic Acid Diethylamide (LSD) as a Model of Psychosis: Mechanism of Action and Pharmacology. In: International Journal of Molecular Sciences. Band 17, Nummer 11, November 2016, S. , doi:10.3390/ijms17111953, PMID 27886063, PMC 5133947 (freier Volltext) (Review).
- C. J. Morgan, H. V. Curran: Ketamine use: a review. In: Addiction. Band 107, Nummer 1, Januar 2012, S. 27–38, doi:10.1111/j.1360-0443.2011.03576.x, PMID 21777321 (Review), reseaualto.be (PDF)
- K. Xu, R. H. Lipsky: Repeated ketamine administration alters N-methyl-D-aspartic acid receptor subunit gene expression: implication of genetic vulnerability for ketamine abuse and ketamine psychosis in humans. In: Experimental biology and medicine. Band 240, Nummer 2, Februar 2015, S. 145–155, doi:10.1177/1535370214549531, PMID 25245072, PMC 4469194 (freier Volltext) (Review).
- F. H. Gawin, H. D. Kleber: Evolving conceptualizations of cocaine dependence. In: The Yale journal of biology and medicine. Band 61, Nummer 2, 1988 Mar-Apr, S. 123–136, PMID 3043925, PMC 2590292 (freier Volltext) (Review).
- N. S. Pilotte, L. G. Sharpe: Cocaine withdrawal alters regulatory elements of dopamine neurons. In: NIDA research monograph. Band 163, 1996, S. 193–202, PMID 8809860 (Review), drugabuse.gov (PDF)
- M. J. Kuhar, N. S. Pilotte: Neurochemical changes in cocaine withdrawal. In: Trends in pharmacological sciences. Band 17, Nummer 7, Juli 1996, S. 260–264, PMID 8756185 (Review).
- N. S. Pilotte: Neurochemistry of cocaine withdrawal. In: Current opinion in neurology. Band 10, Nummer 6, Dezember 1997, S. 534–538, PMID 9425570 (Review).
- X. T. Hu: Cocaine withdrawal and neuro-adaptations in ion channel function. In: Molecular neurobiology. Band 35, Nummer 1, Februar 2007, S. 95–112, PMID 17519508 (Review).
- J. Cabana-Domínguez, C. Roncero, L. Grau-López, L. Rodríguez-Cintas, C. Barral, A. C. Abad, G. Erikson, N. E. Wineinger, B. Torrico, C. Arenas, M. Casas, M. Ribasés, B. Cormand, N. Fernàndez-Castillo: A Highly Polymorphic Copy Number Variant in the NSF Gene is Associated with Cocaine Dependence. In: Scientific Reports. Band 6, 08 2016, S. 31033, doi:10.1038/srep31033, PMID 27498889, PMC 4976312 (freier Volltext).
- G. T. McClelland: The effects and management of crack cocaine dependence. In: Nursing times. Band 101, Nummer 29, 2005 Jul 19-25, S. 26–27, PMID 16052938 (Review)
- T. Steinkellner, M. Freissmuth, H. H. Sitte, T. Montgomery: The ugly side of amphetamines: short- and long-term toxicity of 3,4-methylenedioxymethamphetamine (MDMA, 'Ecstasy'), methamphetamine and D-amphetamine. In: Biological chemistry. Band 392, Nummer 1–2, Januar 2011, S. 103–115, doi:10.1515/BC.2011.016, PMID 21194370, PMC 4497800 (freier Volltext) (Review).
- L. E. Halpin, S. A. Collins, B. K. Yamamoto: Neurotoxicity of methamphetamine and 3,4-methylenedioxymethamphetamine. In: Life sciences. Band 97, Nummer 1, Februar 2014, S. 37–44, doi:10.1016/j.lfs.2013.07.014, PMID 23892199, PMC 3870191 (freier Volltext) (Review).
- Determinants of Tobacco Use and Renaming the FTND to the Fagerström Test for Cigarette Dependence. In: ntr.oxfordjournals.org, abgerufen am 28. Juli 2013.
- James D Belluzzi u. a.: Monoamine Oxidase Inhibitors Allow Locomotor and Rewarding Responses to Nicotine. In: Nature. 14. Dezember 2005, abgerufen am 1. August 2013.
- James D Belluzzi u. a.: Acetaldehyde Enhances Acquisition of Nicotine Self-Administration in Adolescent Rats. In: Nature. 20. Oktober 2004, abgerufen am 1. August 2013.
- J. E. Rose, W. A. Corrigall: Nicotine self-administration in animals and humans: similarities and differences. März 1997. PMID 9089846.
- Fragen zu Tabakzusatzstoffen: Ist die Entwicklung von Nikotinsucht dosisabhängig? 2010. SCENIHR abgerufen am 29. Juli 2013.
- How Tobacco Smoke Causes Disease: The Biology and Behavioral Basis for Smoking-Attributable Disease: A Report of the Surgeon General, Nicotine Addiction: Past and Present. Surgeon General (US), 2010, abgerufen am 29. Juli 2013.
- Development of a rational scale to assess the harm of drugs of potential misuse. (PDF; 127 kB) In: dobrochan.ru. 2007, abgerufen am 9. März 2013.
- Harm reduction on nicotin addiction. (PDF) In: rcplondon.ac.uk. S. 98/99
- L. F. Stead u. a.: Nicotine replacement therapy for smoking cessation. Cochrane Tobacco Addiction Group, 16. Juli 2008, doi:10.1002/14651858.CD000146.pub3
- Nikotinersatz und andere Medikamente zur Raucherentwöhnung. In: DKFZ.de, abgerufen am 6. März 2013.
- H. R. Alpert, G. N. Connolly, L. Biener: A prospective cohort study challenging the effectiveness of population-based medical intervention for smoking cessation. In: Tobacco Control. Band 22, Nummer 1, Januar 2013, S. 32–37, doi:10.1136/tobaccocontrol-2011-050129. PMID 22234781, ISSN 1468-3318.
- M. L. Copersino: Cognitive Mechanisms and Therapeutic Targets of Addiction. In: Current opinion in behavioral sciences. Band 13, Februar 2017, S. 91–98, doi:10.1016/j.cobeha.2016.11.005, PMID 28603756, PMC 5461927 (freier Volltext) (Review).
- S. Wang, Z. Yang, J. Z. Ma, T. J. Payne, M. D. Li: Introduction to deep sequencing and its application to drug addiction research with a focus on rare variants. In: Molecular neurobiology, Band 49, Nummer 1, Februar 2014, S. 601–614, doi:10.1007/s12035-013-8541-4, PMID 23990377, PMC 3948219 (freier Volltext) (Review).
- F. M. Vassoler, G. Sadri-Vakili: Mechanisms of transgenerational inheritance of addictive-like behaviors. In: Neuroscience, Band 264, April 2014, S. 198–206, doi:10.1016/j.neuroscience.2013.07.064, PMID 23920159, PMC 3872494 (freier Volltext) (Review).
- B. M. Sharp, H. Chen: Neurogenetic determinants and mechanisms of addiction to nicotine and smoked tobacco. In: The European journal of neuroscience. [elektronische Veröffentlichung vor dem Druck] September 2018, doi:10.1111/ejn.14171, PMID 30256469 (Review), wiley.com (PDF)
- P. Gorwood, Y. Le Strat, N. Ramoz: Genetics of addictive behavior: the example of nicotine dependence. In: Dialogues in clinical neuroscience. Band 19, Nummer 3, September 2017, S. 237–245, PMID 29302221, PMC 5741107 (freier Volltext) (Review).
- R. C. Crist, B. C. Reiner, W. H. Berrettini: A review of opioid addiction genetics. In: Current opinion in psychology. [elektronische Veröffentlichung vor dem Druck] August 2018, doi:10.1016/j.copsyc.2018.07.014, PMID 30118972 (Review).
- I. Prytkova, A. Goate, R. P. Hart, P. A. Slesinger: Genetics of Alcohol Use Disorder: A Role for Induced Pluripotent Stem Cells? In: Alcoholism, clinical and experimental research. Band 42, Nummer 9, September 2018, S. 1572–1590, doi:10.1111/acer.13811, PMID 29897633, PMC 6120805 (freier Volltext) (Review).
- M. T. Reilly, A. Noronha, D. Goldman, G. F. Koob: Genetic studies of alcohol dependence in the context of the addiction cycle. In: Neuropharmacology. Band 122, August 2017, S. 3–21, doi:10.1016/j.neuropharm.2017.01.017, PMID 28118990 (Review).
- A. B. Hart, H. R. Kranzler: Alcohol Dependence Genetics: Lessons Learned From Genome-Wide Association Studies (GWAS) and Post-GWAS Analyses. In: Alcoholism, clinical and experimental research. Band 39, Nummer 8, August 2015, S. 1312–1327, doi:10.1111/acer.12792, PMID 26110981, PMC 4515198 (freier Volltext) (Review).
- K. J. Verweij, B. P. Zietsch, M. T. Lynskey, S. E. Medland, M. C. Neale, N. G. Martin, D. I. Boomsma, J. M. Vink: Genetic and environmental influences on cannabis use initiation and problematic use: a meta-analysis of twin studies. In: Addiction. Band 105, Nummer 3, März 2010, S. 417–430, doi:10.1111/j.1360-0443.2009.02831.x, PMID 20402985, PMC 2858354 (freier Volltext) (Review).
- A. Agrawal, M. T. Lynskey: Candidate genes for cannabis use disorders: findings, challenges and directions. In: Addiction. Band 104, Nummer 4, April 2009, S. 518–532, doi:10.1111/j.1360-0443.2009.02504.x, PMID 19335651, PMC 2703791 (freier Volltext) (Review).
- J. D. Steketee, P. W. Kalivas: Drug wanting: behavioral sensitization and relapse to drug-seeking behavior. In: Pharmacological reviews. Band 63, Nummer 2, Juni 2011, S. 348–365, doi:10.1124/pr.109.001933, PMID 21490129, PMC 3082449 (freier Volltext) (Review).
- M. J. Robinson, A. M. Fischer, A. Ahuja, E. N. Lesser, H. Maniates: Roles of "Wanting" and "Liking" in Motivating Behavior: Gambling, Food, and Drug Addictions. In: Current topics in behavioral neurosciences. Band 27, 2016, S. 105–136, doi:10.1007/7854_2015_387, PMID 26407959 (Review), wesleyan.edu (PDF; 482 kB)
- C. M. Olsen: Natural rewards, neuroplasticity, and non-drug addictions. In: Neuropharmacology. Band 61, Nummer 7, Dezember 2011, S. 1109–1122, doi:10.1016/j.neuropharm.2011.03.010, PMID 21459101, PMC 3139704 (freier Volltext) (Review).
- N. D. Volkow, M. Morales: The Brain on Drugs: From Reward to Addiction. In: Cell. Band 162, Nummer 4, August 2015, S. 712–725, doi:10.1016/j.cell.2015.07.046, PMID 26276628 (freier Volltext) (Review).
- E. J. Nestler: Epigenetic mechanisms of drug addiction. In: Neuropharmacology. Band 76 Pt B, Januar 2014, S. 259–268, doi:10.1016/j.neuropharm.2013.04.004, PMID 23643695, PMC 3766384 (freier Volltext) (Review).
- D. M. Walker, E. J. Nestler: Neuroepigenetics and addiction. In: Handbook of clinical neurology. Band 148, 2018, S. 747–765, doi:10.1016/B978-0-444-64076-5.00048-X, PMID 29478612, PMC 5868351 (freier Volltext) (Review).
- G. F. Koob, N. D. Volkow: Neurobiology of addiction: a neurocircuitry analysis. In: The lancet. Psychiatry. Band 3, Nummer 8, August 2016, S. 760–773, doi:10.1016/S2215-0366(16)00104-8, PMID 27475769, PMC 6135092 (freier Volltext) (Review).
- N. D. Volkow, G. F. Koob, A. T. McLellan: Neurobiologic Advances from the Brain Disease Model of Addiction. In: The New England Journal of Medicine. Band 374, Nummer 4, Januar 2016, S. 363–371, doi:10.1056/NEJMra1511480, PMID 26816013, PMC 6135257 (freier Volltext) (Review).
- A. Zehra, J. Burns, C. K. Liu, P. Manza, C. E. Wiers, N. D. Volkow, G. J. Wang: Cannabis Addiction and the Brain: a Review. In: Journal of neuroimmune pharmacology: the official journal of the Society on NeuroImmune Pharmacology. Band 13, Nummer 4, Dezember 2018, S. 438–452, doi:10.1007/s11481-018-9782-9, PMID 29556883 (Review), springer.com (PDF; 1,9 MB)
- Peter Miller (Hrsg.): Biological research on addiction. Elsevier, Amsterdam, Boston, 2013, ISBN 978-0-12-398360-2, S. 171, OCLC 828298745. Vorschau Google Books.
- H. C. Tomasiewicz, M. M. Jacobs, M. B. Wilkinson, S. P. Wilson, E. J. Nestler, Y. L. Hurd: Proenkephalin mediates the enduring effects of adolescent cannabis exposure associated with adult opiate vulnerability. In: Biological psychiatry. Band 72, Nummer 10, November 2012, S. 803–810, doi:10.1016/j.biopsych.2012.04.026, PMID 22683090, PMC 3440551 (freier Volltext).
- M. Ellgren, S. M. Spano, Y. L. Hurd: Adolescent cannabis exposure alters opiate intake and opioid limbic neuronal populations in adult rats. In: Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. Band 32, Nummer 3, März 2007, S. 607–615, doi:10.1038/sj.npp.1301127, PMID 16823391.
- L. H. Parsons, Y. L. Hurd: Endocannabinoid signalling in reward and addiction. In: Nature reviews. Neuroscience. Band 16, Nummer 10, Oktober 2015, S. 579–594, doi:10.1038/nrn4004, PMID 26373473, PMC 4652927 (freier Volltext) (Review).
- C. Cadoni, A. Pisanu, M. Solinas, E. Acquas, G. Di Chiara: Behavioural sensitization after repeated exposure to Delta 9-tetrahydrocannabinol and cross-sensitization with morphine. In: Psychopharmacology. Band 158, Nummer 3, November 2001, S. 259–266, doi:10.1007/s002130100875, PMID 11713615.
- W. L. Sun, P. M. Quizon, J. Zhu: Molecular Mechanism: ERK Signaling, Drug Addiction, and Behavioral Effects. In: Progress in molecular biology and translational science. Band 137, 2016, S. 1–40, doi:10.1016/bs.pmbts.2015.10.017, PMID 26809997, PMC 5330621 (freier Volltext) (Review).
- L. V. Panlilio, C. Zanettini, C. Barnes, M. Solinas, S. R. Goldberg: Prior exposure to THC increases the addictive effects of nicotine in rats. In: Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. Band 38, Nummer 7, Juni 2013, S. 1198–1208, doi:10.1038/npp.2013.16, PMID 23314220, PMC 3656362 (freier Volltext).
- Stephen J. Kohut: Interactions between nicotine and drugs of abuse: a review of preclinical findings. In: The American Journal of Drug and Alcohol Abuse, 43, 2016, S. 155; doi:10.1080/00952990.2016.1209513 (Review); PMC 5602608 (freier Volltext).
- K. MacDonald, K. Pappas: WHY NOT POT?: A Review of the Brain-based Risks of Cannabis. In: Innovations in clinical neuroscience. Band 13, Nummer 3–4, 2016 Mar-Apr, S. 13–22, PMID 27354924, PMC 4911936 (freier Volltext) (Review).
- L. V. Panlilio, Z. Justinova: Preclinical Studies of Cannabinoid Reward, Treatments for Cannabis Use Disorder, and Addiction-Related Effects of Cannabinoid Exposure. In: Neuropsychopharmacology. Band 43, Nummer 1, Januar 2018, S. 116–141, doi:10.1038/npp.2017.193, PMID 28845848, PMC 5719102 (freier Volltext) (Review).
- D. P. Covey, J. M. Wenzel, J. F. Cheer: Cannabinoid modulation of drug reward and the implications of marijuana legalization. In: Brain Research. Band 1628, Pt ADezember 2015, S. 233–243, doi:10.1016/j.brainres.2014.11.034, PMID 25463025, PMC 4442758 (freier Volltext) (Review).
- J. Renard, W. J. Rushlow, S. R. Laviolette: What Can Rats Tell Us about Adolescent Cannabis Exposure? Insights from Preclinical Research. In: Canadian journal of psychiatry. Revue canadienne de psychiatrie. Band 61, Nummer 6, 06 2016, S. 328–334, doi:10.1177/0706743716645288, PMID 27254841, PMC 4872245 (freier Volltext) (Review).
- D. Kandel: Stages in adolescent involvement in drug use. In: Science. Band 190, Nummer 4217, November 1975, S. 912–914, PMID 1188374.
- K. Yamaguchi, D. B. Kandel: Patterns of drug use from adolescence to young adulthood: II. Sequences of progression. In: American Journal of Public Health. Band 74, Nummer 7, Juli 1984, S. 668–672, PMID 6742252, PMC 1651663 (freier Volltext).
- D. Kandel, K. Yamaguchi: From beer to crack: developmental patterns of drug involvement. In: American Journal of Public Health. Band 83, Nummer 6, Juni 1993, S. 851–855, PMID 8498623, PMC 1694748 (freier Volltext).
- D. B. Kandel (Hrsg.): Stages and Pathways of Drug Involvement: Examining the Gateway Hypothesis, Cambridge University Press, 2002, ISBN 978-0-521-78969-1, S. 4.
- National Academies of Sciences, Engineering, and Medicine. Health and Medicine Division. Board on Population Health and Public Health Practice. Committee on the Review of the Health Effects of Electronic Nicotine Delivery Systems: Public Health Consequences of E-Cigarettes. In: National Academies of Sciences. 2018. doi:10.17226/24952. PMID 29894118. (Review) (freier Volltext), (im Original: „There is substantial evidence [Hervorhebung im Original] that e-cigarette use increases risk of ever using combustible tobacco cigarettes among youth and young adults.“)
- D. M. Lydon, S. J. Wilson, A. Child, C. F. Geier: Adolescent brain maturation and smoking: what we know and where we’re headed. In: Neuroscience and biobehavioral reviews. Band 45, September 2014, S. 323–342, doi:10.1016/j.neubiorev.2014.07.003, PMID 25025658, PMC 4451244 (freier Volltext) (Review).
- M. Yuan, S. J. Cross, S. E. Loughlin, F. M. Leslie: Nicotine and the adolescent brain. In: The Journal of physiology. Band 593, Nummer 16, August 2015, S. 3397–3412, doi:10.1113/JP270492, PMID 26018031, PMC 4560573 (freier Volltext) (Review).
- W. M. Cox, E. Klinger, J. S. Fadardi: Free will in addictive behaviors: A matter of definition. In: Addictive behaviors reports. Band 5, Juni 2017, S. 94–103, doi:10.1016/j.abrep.2017.03.001, PMID 29450231, PMC 5800588 (freier Volltext) (Review), PDF.
- Beste Suchtprävention: Stärkung kindlicher Persönlichkeit. (Nicht mehr online verfügbar.) In: psychologie.at. Archiviert vom Original am 24. Februar 2009; abgerufen am 2. Februar 2014.
- Peter Degkwitz: Abhängigkeit oder selbstbestimmtes Individuum? Anmerkung zur Auseinandersetzung um das Verständnis von Drogenkonsum und -abhängigkeit. In: Akzeptierende Drogenarbeit. 1999, S. 38.
- M. Farrell, J. Ward, R. Mattick, W. Hall, G. Stimson, D. des Jarlais u. a.: Methadone maintenance treatment in opiate dependence: a review. In: BMJ. 309, 1994, S. 997–1001.
- Freye: Opioide in der Medizin. 8. Auflage. Springer, 2010.
- M. Daglish, A. Lingford-Hughes, D. Nutt: Human functional neuroimaging connectivity research in dependence. In: Reviews in the neurosciences. Band 16, Nummer 2, 2005, S. 151–157, PMID 15957578 (Review).
- T. Kienast, J. Wrase, A. Heinz: [Neurobiology of substance-related addiction: findings of neuroimaging]. In: Fortschritte der Neurologie-Psychiatrie. Band 76 Suppl 1, Mai 2008, S. S68–S76, doi:10.1055/s-2008-1038141, PMID 18461548 (Review).
- K. D. Ersche, G. B. Williams, T. W. Robbins, E. T. Bullmore: Meta-analysis of structural brain abnormalities associated with stimulant drug dependence and neuroimaging of addiction vulnerability and resilience. In: Current opinion in neurobiology. Band 23, Nummer 4, August 2013, S. 615–624, doi:10.1016/j.conb.2013.02.017, PMID 23523373 (freier Volltext) (Review).
- C. E. Yesalis, J. R. Vicary, W. E. Buckley, A. L. Streit, D. L. Katz, J. E. Wright: Indications of psychological dependence among anabolic-androgenic steroid abusers. In: NIDA research monograph. Band 102, 1990, S. 196–214, PMID 2079973 (Review).