6-Methyl-5-hepten-2-on
6-Methyl-5-hepten-2-on ist eine chemische Verbindung aus der Gruppe der Ketone.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
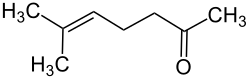 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 6-Methyl-5-hepten-2-on | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H14O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit zitronenartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 126,20 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,85 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
173 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,439 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
6-Methyl-5-hepten-2-on ist eines der wichtigsten flüchtigen Aromen von Tomaten.[4][5] Die Verbindung wurde ursprünglich in Zitronengras identifiziert, wurde aber in den ätherischen Ölen von Palmarosa, Zitronen, Eisenkraut, Geranien und anderen nachgewiesen. Ebenfalls wurde sie in Früchten (wie zum Beispiel Äpfeln, Aprikosen, Süß- und Sauerkirsche), aber auch in vielen weiteren Pflanzenprodukten (wie zum Beispiel Heidelbeeren, Preiselbeeren, Kartoffeln, Ingwer, Kakao, Tee, Sternfrucht, Reis und weiteren) nachgewiesen.[6] Einige Bienenarten geben die Verbindung ab, wobei andere auf diese Substanz reagieren.[7]
Gewinnung und Darstellung
Zur industriellen Synthese von 6-Methyl-5-hepten-2-on sind zahlreiche Verfahren bekannt, die sich vor allem im Punkt Rohstoffauswahl unterscheiden. Viele der technisch genutzten Verfahren beruhen auf petrochemischen Ausgangsstoffen und sind somit vollkommen synthetisch. Die Extraktion aus Zitronengrasöl oder Citral in wässriger Lösung mit Kaliumcarbonat und anschließender Destillation und Vakuumfraktionierung hat nur wenig Bedeutung.
Hoffmann-La Roche / DSM-Prozess
Die Synthese von 6-Methyl-5-hepten-2-on nach dem Hoffmann-La Roche / DSM-Prozess geht von nur zwei unterschiedlichen Grundverbindungen, dem C3-Baustein Aceton und dem C2-Baustein Acetylen aus, alle weiteren Verbindungen wirken katalytisch oder werden bei der Reaktion wieder freigesetzt und können wieder zur vorherigen Verfahrensstufe zurückgeführt werden.
Ausgehend von Aceton (1), welches unter Faworski-Babayan-Bedingungen zu 2-Methyl-3-butin-2-ol (2) ethinyliert wird, wird durch eine selektive Hydrierung an einem Lindlar-Katalysator 2-Methyl-3-buten-2-ol (3) hergestellt. Parallel wird ebenfalls aus Aceton durch eine säurekatalysierte Acetalisierung mit Methanol das Acetondimethylacetal (4) (2,2-Dimethoxypropan) erzeugt, welches pyrolytisch unter Abspaltung von einem Molekül Methanol zum Isopropenylmethylether (5) gespalten wird. Dieser reagiert zusammen mit dem zuvor erzeugten 2-Methyl-3-buten-2-ol unter saurer Katalyse (z. B. Phosphorsäure) zu dem Allylvinylether (6). Bei erhöhten Temperaturen geht dieser eine Claisen-Umlagerung, also eine [3.3]-sigmatrope Umlagerungsreaktion, ein. Diese verläuft über einen sechsgliedrigen Übergangszustand (7), wodurch das Endprodukt 6-Methyl-5-hepten-2-on (8) gebildet wird.[8]

Auch möglich ist die Synthese ausgehend von Acetessigester und 2-Methyl-3-buten-2-ol mit Aluminiumalkoholat durch Carroll-Umlagerung gefolgt von einer Pyrolyse des Esters.[6][9] Es sind auch weitere Syntheseverfahren bekannt.[10][11]
Eigenschaften
6-Methyl-5-hepten-2-on ist eine farblose Flüssigkeit mit zitronenartigem Geruch, die schwer löslich in Wasser ist.[2]
Verwendung
6-Methyl-5-hepten-2-on kann bei der Synthese von Thyrsiferyl 23-Acetat verwendet, das als antileukämischer Auslöser der Apoptose wirkt.[3] Es wird auch als Aromastoff eingesetzt.[6]
Sicherheitshinweise
Die Dämpfe von 6-Methyl-5-hepten-2-on können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 50 °C, Zündtemperatur 250 °C) bilden.[2]
Einzelnachweise
- Eintrag zu 6-METHYL-5-HEPTEN-2-ONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Oktober 2021.
- Eintrag zu 6-Methyl-5-hepten-2-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Dezember 2018. (JavaScript erforderlich)
- Datenblatt 6-Methyl-5-hepten-2-one, 98% bei AlfaAesar, abgerufen am 4. Dezember 2018 (PDF) (JavaScript erforderlich).
- Datenblatt 6-Methyl-5-hepten-2-one, natural, ≥98%, FCC bei Sigma-Aldrich, abgerufen am 4. Dezember 2018 (PDF).
- Sandrine Mathieu, Valeriano Dal Cin u. a.: Flavour compounds in tomato fruits: identification of loci and potential pathways affecting volatile composition. In: Journal of Experimental Botany. 60, 2009, S. 325, doi:10.1093/jxb/ern294.
- George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. CRC Press, 2016, ISBN 978-1-4200-9086-4, S. 1284 (eingeschränkte Vorschau in der Google-Buchsuche).
- Rainer Radtke: Die Kleptoparasitische Neotropische Biene Lestrimelitta limao Verhalten und chemische Kommunikation bei Raubzügen auf Nester anderer stachelloser Bienen. diplom.de, 1997, ISBN 3-8324-0545-3, S. 88 (eingeschränkte Vorschau in der Google-Buchsuche).
- Charles S. Sell: Terpenoids. In: Kirk‐Othmer Encyclopedia of Chemical Technology. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. September 2006, doi:10.1002/0471238961.2005181602120504.a01.pub2.
- Eberhard Breitmaier: Terpene Aromen, Düfte, Pharmaka, Pheromone. Springer-Verlag, 2013, ISBN 978-3-322-94727-7, S. 127 (eingeschränkte Vorschau in der Google-Buchsuche).
- Günther Ohloff: Riechstoffe und Geruchssinn - Die molekulare Welt der Düfte. Springer-Verlag, 2013, ISBN 978-3-662-09768-7, S. 110 (eingeschränkte Vorschau in der Google-Buchsuche).
- Takashi NISHIDA, Yoshin TAMAI u. a.: New Industrial Synthesis of 6-Methyl-5-hepten-2-one by Phase Transfer Reaction. In: Journal of Japan Oil Chemists' Society. 33, 1984, S. 606, doi:10.5650/jos1956.33.606.
