3,5-Diiodphenol
3,5-Diiodphenol ist eine chemische Verbindung, die sowohl zu den Phenolen als auch zu den Halogenaromaten zählt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
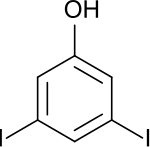 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 3,5-Diiodphenol | ||||||||||||
| Summenformel | C6H4I2O | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 345,9 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| pKS-Wert |
8,10 (25 °C)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Darstellung
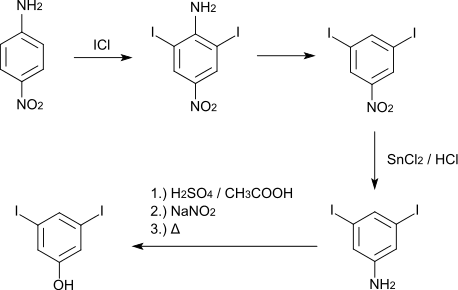
Die mehrstufige Synthese von 3,5-Diiodphenol geht vom p-Nitroanilin aus, das mit Iodchlorid zum 2,6-Diiod-4-nitroanilin iodiert wird. Deaminierung führt dann zum 3,5-Diiodnitrobenzol, das durch Reduktion der Aminogruppe in 3,5-Diiodanilin überführt wird. Verkochen des Diazoniumsalzes führt schließlich zum gewünschten Produkt.[3]
Eine weitere Synthesemöglichkeit geht vom 3,5-Dinitroanisol aus, das zunächst mit Essigsäure, Platin(IV)-oxid und Wasserstoff zum 3,5-Diaminoanisol reduziert wird. Dieses wird mit Natriumnitrit, Schwefelsäure und Essigsäure diazotiert und mit Natriumiodid und elementarem Iod in 3,5-Diiodanisol überführt. Die gewünschte Verbindung entsteht schließlich durch Etherspaltung mit Iodwasserstoff in Essigsäure.[4]
Eigenschaften
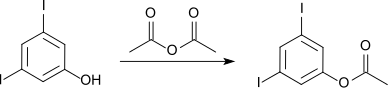
Veresterung mit Essigsäureanhydrid liefert das Acetat, das bei 79 °C schmilzt.[1]
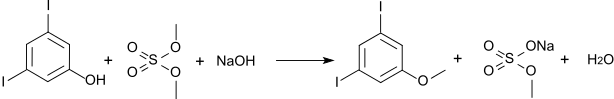
Der Methylether kann durch Methylierung mit Dimethylsulfat hergestellt werden und ist auch unter dem Trivialnamen 3,5-Diiodanisol bekannt. Sein Schmelzpunkt liegt bei 85 °C.[1]
Einzelnachweise
- John B. Buckingham: Dictionary of Organic Compounds. 6. Auflage. Band 8. Chapman & Hall, London 1996, ISBN 0-412-54090-8, S. 2499.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- P. D. Bolton, F. M. Hall, J. Kudrynski: "Additive substituent effects on the ionization of meta-substituted phenols", in: Australian Journal of Chemistry, 1968, 21 (6), S. 1541–1549; doi:10.1071/CH9681541.
- James E. Redman, Ph.D. Thesis, Kap. 3-3: "Porphyrins for SAMs"; Volltext (Memento vom 2. März 2010 im Internet Archive).