Limonenoxide
Limonenoxide (auch Dipentenoxide) heißen bestimmte chemische Verbindungen, die sich von Limonenen ableiten und aus diesen Stoffen durch Oxidation entstehen. Chemisch handelt es sich um cyclische Ether von Monoterpenen. Mehrere Limonenoxide sind allergieauslösend und mitverantwortlich für die allergiefördernde Wirkung vieler ätherischer Öle und der darin enthaltenen Monoterpene.[1][2][3][4][5]
Der Gehalt von Limonenoxiden in ätherischen Ölen von Zitrus-Arten steigt bereits innerhalb weniger Wochen nach Extraktion und bei Zimmertemperatur.[6] Der Anstieg des Limonenoxidgehalts in Kümmelöl wird sowohl von Wärme als auch Licht beschleunigt.[7]
Mitglieder der Stoffgruppe
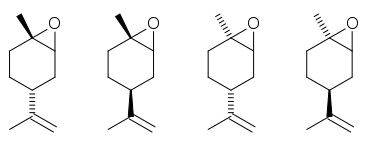
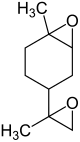
Zu den Limonenoxiden zählen
- Limonen-1,8-monoxid, siehe 1,8-Cineol
- Limonen-1,2-monoxide (LMO) sind Zwischenprodukte bei der Synthese von Carveol und Carvon:[8]
- cis-(+)- und trans-(+)-Limonen-1,2-oxid (CAS-Nummer 1195-92-2), zwei Allergene aus der Oxidation von D-(+)-Limonen. Farblose, die Augen und Haut reizende Flüssigkeiten mit leichtem Zitrusgeruch und einem Siedepunkt von 74 bis 75 °C (cis) und 77 °C (trans), bzw. 113–114 °C bei 67 mbar. Die Dichte ist 0,93 g/ml.[9]
- cis-(–)- und trans-(–)-Limonen-1,2-oxid, aus der Oxidation von L-(–)-Limonen
- Limonen-1,2:8,9-dioxide (LDO, CAS-Nummer 96-08-2) sind ebenfalls farblose Flüssigkeiten mit leichtem Zitrusgeruch. Sie haben einen Siedepunkt von 242 °C und eine Dichte von 1,03 g/ml. Sie werden verwendet, um die Viskosität von Epoxidharzen zu verringern.[10][11]
Herstellung
Die Herstellung eines Limonen-1,2-oxid-Racemats erfolgt einfach über säurekatalysierte Oxidation des entsprechenden Limonens mit Luft oder mithilfe von Persäuren wie Peressigsäure.[12] Bei der stereospezifischen Synthese von Limonen-1,2-oxiden macht man sich neben fraktionierter Destillation Asymmetrieen verschiedener Reaktionen zunutze. Zum Beispiel verläuft die Umlagerung der beiden D-Limonen-1,2-oxide zum entsprechenden Dihydrocarvon unterschiedlich schnell und durch Abbruch der Reaktion kann fast reines trans-Isomer zurückgehalten werden.[13]
Die Oxidation von Limonen mit N-Sulfonyloxaziridin verläuft doppelt asymmetrisch; während D-Limonen fast gleiche Anteile im Racemat ergibt, ist die Reaktion von L-Limonen stark enantioselektiv:[14]
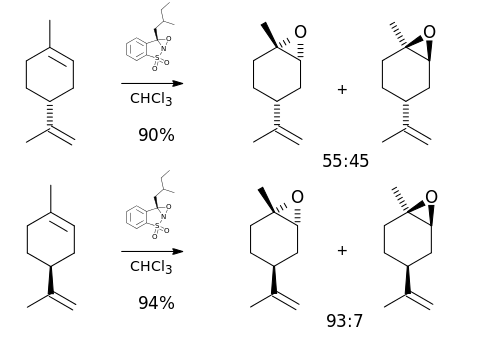
Pharmakologie
Limonenoxide erhöhen die Aufnahmegeschwindigkeit von Haloperidol durch die menschliche Epidermis; der Mechanismus scheint das aggressive Verhalten der Oxide gegenüber den Hautschichten zu sein.[15]
Einzelnachweise
- A.T. Karlberg et al.: Air oxidation of d-limonene (the citrus solvent) creates potent allergens. In: Contact Dermatitis. 26/5/1992, S. 332–340; PMID 1395597.
- M. Matura et al.: Not only oxidized R-(+)- but also S-(–)-limonene is a common cause of contact allergy in dermatitis patients in Europe. In: Contact Dermatitis. 55/5/2006, S. 274–279; PMID 17026692.
- Q. Wei et al.: Toxicity study of the volatile constituents of Myoga utilizing acute dermal irritation assays and the Guinea-pig Maximization test. In: J Occup Health. 48/6/2006, S. 480–486; PMID 17179641.
- B.M. Hausen et al.: Degradation products of monoterpenes are the sensitizing agents in tea tree oil. In: American Journal of Contact Dermatitis. 10/2/1999, S. 68–77; PMID 10357714.
- M.A. Bergstrom et al.: Conjugated dienes as prohaptens in contact allergy: in vivo and in vitro studies of structure-activity relationships, sensitizing capacity, and metabolic activation. In: Chemical Research in Toxicology 2006, Band 19, S. 760–769; PMID 16780354.
- H.S. Choi und M. Sawamura: Effects of storage conditions on the composition of Citrus tamurana Hort. ex Tanaka (hyuganatsu) essential oil. In: Bioscience, Biotechnology, and Biochemistry. 66/2/2002. S. 439–443. PMID 11999424
- A.M. Spanier (Hrsg.): Food Flavours and Chemistry. Advances of the New Millennium. RSC Publishing. 2001, ISBN 0-85404-875-8. S. 518 ff.
- Patent US6835686: Catalyst system and process for rearrangement of epoxides to allylic alcohols. Veröffentlicht am 28. Dezember 2004, Erfinder: Gennadiy G. Kolomeyer, Jacob S. Oyloe.
- Datenblatt Limonenoxide bei Acros, abgerufen am 19. Februar 2010.
- Patent US3073792: Composition comprising epoxypolybutadiene and limonene diepoxide. Veröffentlicht am 15. Januar 1963, Erfinder: Frank P. Greenspan.
- Datenblatt bei Arkema (Memento vom 19. November 2012 im Internet Archive) (PDF; 68 kB).
- Patent US3014929: Method of making carvomenthene oxide. Veröffentlicht am 26. Dezember 1961, Erfinder: Frank P. Greenspan, Seymour M. Linder.
- Patent US4296257: Process for producing dihydrocarvone geometric isomers. Veröffentlicht am 20. Oktober 1981, Erfinder: Carlos G. Cardenas, Zia U. Din.
- T. Katsuki (Hrsg.): Asymmetric Oxidation Reactions: a practical approach in chemistry. Oxford Univ. Press. 2001, ISBN 0-19-850201-X, S. 48–49.
- H.K. Vaddi et al.: Oxide terpenes as human skin penetration enhancers of haloperidol from ethanol and propylene glycol and their modes of action on stratum corneum. In: Biol Pharm Bull. 26/2/2003, S. 220–228; PMID 12576684.