Wurminfektionen der Katze
Wurminfektionen der Katze – die Ansteckung (Infektion) von Katzen (Felidae) mit parasitisch lebenden Würmern – kommen häufig vor. Die meisten Wurmarten treten sowohl bei Haus- als auch den übrigen Katzen weltweit auf, hinsichtlich der Befallshäufigkeit gibt es aber regionale, tierartliche und durch die Lebensweise bedingte Unterschiede. Nach der Einordnung der entsprechenden Parasiten in die zoologische Systematik lassen sich die Infektionen in solche durch Faden- und Plattwürmer – bei letzteren vor allem Band- und Saugwürmer – einteilen, andere Stämme sind tiermedizinisch ohne Bedeutung. Während Fadenwürmer zumeist keinen Zwischenwirt für ihre Vermehrung benötigen, verläuft der Entwicklungszyklus bei Plattwürmern stets über Zwischenwirte.
Für die meisten Würmer sind Katzen als Raubtiere der Endwirt. Die Würmer besiedeln als sogenannte Endoparasiten („Innenschmarotzer“) verschiedene innere Organe, rufen aber zumeist keine oder nur geringe Krankheitserscheinungen hervor. Die Infektion muss sich also nicht zwangsläufig auch in einer Wurmerkrankung (Helminthose) äußern. Für die meisten Parasiten lässt sich eine Infektion durch eine Untersuchung des Kots auf Eier oder Larven nachweisen. Einige bei Katzen vorkommende Würmer können auch auf den Menschen übergehen und sind damit Zoonose-Erreger. Von größerer Bedeutung sind hierbei der Katzenspul- und der Fuchsbandwurm. Insbesondere solche Wurminfektionen sollten durch regelmäßige Entwurmung von enger mit dem Menschen in Kontakt lebenden Katzen bekämpft werden.

Infektionen durch Fadenwürmer
Bei Katzen parasitieren verschiedene Vertreter der Fadenwürmer (Nematoda), vor allem Spul-, Haken-, Lungen-, Haar- und Magenwürmer. Koinfektionen durch Kokzidien sind vor allem bei Katzenwelpen häufig.[1]
Spulwurmbefall

- → Hauptartikel: Spulwurmbefall der Katze
Der häufigste Spulwurm bei den meisten Katzen ist Toxocara mystax (Syn. Toxocara cati), seltener ist der Befall mit Toxascaris leonina. Lediglich bei Ozelots in Texas war T. leonina bei jedem Tier nachweisbar und damit der häufigste Parasit[2], bei Rotluchsen in Nebraska wurde er fast genauso oft beobachtet wie T. mystax.[3] Beide Spulwurmarten kommen weltweit vor und der Spulwurmbefall ist eine sehr häufig auftretende Endoparasitose. Die bis zu 10 cm langen adulten Spulwürmer leben im Dünndarm. Die Wurmweibchen produzieren sehr viele Eier, die mit dem Kot in die Umwelt gelangen. In den Eiern entwickeln sich nach etwa vier Wochen die infektiösen Larven.


Die Ansteckung erfolgt stets peroral und kann auf drei Wegen erfolgen:
- über die Aufnahme mit Larven infizierter Transportwirte,
- von der Katzenmutter auf ihre Welpen über die Muttermilch (nur bei T. mystax) oder
- als Schmutzinfektion durch Aufnahme larvenhaltiger Eier.
Prinzipiell benötigen Spulwürmer keine Zwischenwirte. Dennoch ist die Ansteckung über Transportwirte wie Nagetiere der häufigste Infektionsweg bei erwachsenen Katzen. Die Larven wandern im Transportwirt durch die Darmwand in die Muskulatur oder innere Organe. In der Katze werden sie bei der Verdauung freigesetzt. Bei einer Schmutzinfektion nimmt die Katze selbst larvenhaltige Eier auf. Die Larven werden im Magen freigesetzt, durchbohren die Magen- oder Dünndarmwand und gelangen über den Blutkreislauf in die Lunge. Von hier aus werden sie hochgehustet und gelangen durch Abschlucken des Sputums wieder in den Dünndarm, wo sie sich zu den adulten Würmern häuten. Bei T. mystax können die Larven – wie in den Transportwirten – auch über den Blutweg in andere Organe (unter anderem die Milchdrüse) wandern und dort ein Ruhestadium in abgekapselten Knötchen einnehmen. Die hormonell ausgelöste Mobilisierung dieser ruhenden Larven in der Milchdrüse zum Ende der Trächtigkeit ist die Grundlage des dritten Infektionsweges, welcher der häufigste bei Katzenwelpen ist. Die über die Milch ausgeschiedenen Larven gelangen in den Darm der Kätzchen und verhalten sich im weiteren wie bei der Infektion über Transportwirte.
Im Allgemeinen bleibt der Befall mit Spulwürmern bei Katzen symptomlos. Erst bei stärkerem Befall treten – vor allem bei Jungtieren – unspezifische Symptome wie breiiger Kot sowie infolge eines Nährstoffmangels struppiges Fell, Haarausfall, Abmagerung und Austrocknung auf. Ein massiver Befall kann bei Jungtieren auch zu Wachstumsstörungen des Skeletts mit Verformungen der Knochen und aufgetriebenen Gelenken führen. Sehr selten kommt es zu einem Darmverschluss durch die Anhäufung von Würmern oder zu einer Bauchfellentzündung infolge die Darmwand durchbohrender Würmer. In diesen Fällen treten schwere Allgemeinstörungen („akuter Bauch“) auf.
Die Diagnose kann bei Würmern in Erbrochenem bereits ohne Spezialuntersuchungen gestellt werden. Relativ sicher kann ein Spulwurmbefall durch mikroskopischen Nachweis der über das Flotationsverfahren aus dem Kot herausgelösten Eier nachgewiesen werden.
Hakenwurmbefall
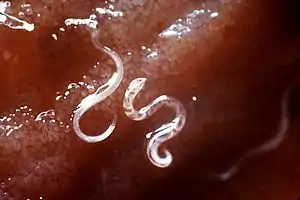
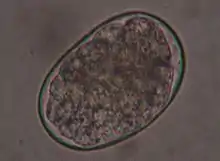
Hakenwürmer kommen bei Katzen häufig vor, insbesondere Ancylostoma tubaeforme. Andere Hakenwürmer wie Ancylostoma caninum (Hauptwirt: Hunde) und Uncinaria stenocephala (Hauptwirt: Füchse) werden bei Katzen dagegen deutlich seltener beobachtet. Hakenwürmer sind bis zu 1,5 cm lang und Dünndarmparasiten. Die Larven dieser Hakenwürmer werden entweder durch Fressen von Transportwirten (Nagetiere) aufgenommen oder bohren sich durch die Haut der Katze (perkutane Infektion).
Die Infektion mit Hakenwürmern bleibt bei Katzen häufig symptomlos. Bei stärkerem Befall können sie Abmagerung, Blutarmut oder Durchfall auslösen. Der Nachweis der Infektion erfolgt wie bei Spulwürmern über den Nachweis der Eier im Kot mittels Flotationsverfahren. Sie sind oval, kleiner als Spulwurmeier (etwa 60×40 µm groß) und im Inneren sind bereits bei der Eiablage Furchungsstadien erkennbar.
Magenwurmbefall (Ollulanose)
Magenwürmer (vor allem Ollulanus tricuspis) sind bis zu einem Zentimeter lang und besiedeln die Magenschleimhaut, wo sie sich in deren Schleimschicht oder in den Öffnungen der Magendrüsen einnisten. Die gesamte Entwicklung von O. tricuspis findet im Magen der Katze statt, die von den Weibchen abgegebenen Larven entwickeln sich innerhalb desselben Tieres zu den adulten Würmern. Andere Tiere stecken sich durch das Fressen von Erbrochenem befallener Katzen an.
O. tricuspis ruft bei Hauskatzen nur selten klinische Erscheinungen hervor. Ein stärkerer Befall zeigt sich in gelegentlichem Erbrechen. Andere Katzen können dagegen schwerere Krankheitsbilder mit Fressunlust, Abmagerung und Austrocknung zeigen. Die Infektion kann durch Nachweis der Würmer in Magenspülproben oder Erbrochenem nachgewiesen werden. Da O. tricuspis lebendgebärend (larvipar) ist, sind im Kot keine Wurmeier und nur ausnahmsweise Larven nachweisbar.[4]
Lungenwurmbefall (Aelurostrongylose)
Der Lungenwurm Aelurostrongylus abstrusus ist bis zu einem Zentimeter lang und besiedelt die Lunge, genauer die kleinen Bronchien und Lungenbläschen. Im Gegensatz zu den zuvor behandelten Fadenwürmern benötigen Lungenwürmer für ihre Entwicklung einen Zwischenwirt. Die Wurmweibchen legen Eier, aus denen noch in den Luftwegen die Larve L1 schlüpft. Diese wird hochgehustet, abgeschluckt und gelangt nach der Passage durch den Magen-Darm-Trakt über den Kot in die Außenwelt. Hier sind die Larven in feuchter Umgebung bis zu einem halben Jahr infektiös. Sie dringen in verschiedene Schnecken ein, die als Zwischenwirt dienen, und entwickeln sich in diesen über die Larve L2 zur Larve L3. Zumeist infizieren sich Katzen aber nicht durch das Fressen von Schnecken, sondern über Transportwirte wie Amphibien, Reptilien, Vögel und Nagetiere, die diese Schnecken zuvor aufgenommen haben. Nach der Aufnahme bohrt sich die Larve durch die Magen- oder Darmwand der Katze und gelangt über den Blutkreislauf in die Lunge. Die Präpatenzzeit – die Zeitspanne von der Infektion bis zur Ausscheidung der ersten Larven – beträgt etwa sechs Wochen.
Der Lungenwurmbefall ruft bei Katzen nur selten Krankheitserscheinungen hervor, er gilt als selbstausheilend. Erst bei massivem Befall oder Störungen des Abwehrsystems kann es zu Atemwegsbeschwerden wie Husten, erschwerter Atmung, Niesen, Augen- und Nasenausfluss sowie Fressunlust, Abmagerung und Antriebslosigkeit kommen. Sehr selten treten plötzliche Todesfälle auf, wenn besonders viele Larven in den Luftwegen schlüpfen. Der Lungenwurmbefall wird über den Nachweis der bis zu 400 µm langen Larven im Kot mittels Larvenauswanderungsverfahren gestellt, wobei zu beachten ist, dass sie unregelmäßig über den Kot ausgeschieden werden. Aussagekräftiger ist der Nachweis in Lungenspülproben oder Lungenbiopsien.[5]
Haarwurmbefall
Haarwürmer (Capillaria ssp.) sind sehr dünne, 0,7 bis 8 cm lange Fadenwürmer.
Am häufigsten kommen Haarwürmer als Parasiten im Magen-Darm-Trakt bei Katzen vor, beispielsweise Capillaria putorii. Sie gelten als wenig krankheitsauslösend, rufen aber gelegentlich Erbrechen und Durchfall und selten auch Magengeschwüre mit Blutarmut hervor.[6] Die Eier von Magen-Darm-Haarwürmern sind oval, etwa 60–70 × 35–40 µm groß und lassen sich mittels Flotationsverfahren nachweisen.[7]
Der Lungenhaarwurm (Capillaria aerophila) ist zwar bei Wildtieren wie Igeln oder Füchsen weit verbreitet, bei Katzen aber sehr selten. Der 25 bis 35 mm lange Wurm besiedelt die Luftwege. Die Eier werden – wie bei Spul- und Lungenwürmern – hochgehustet, abgeschluckt und über den Kot ausgeschieden. Als Zwischenwirt dienen Regenwürmer, der Parasit wird aber zumeist über zwischengeschaltete Transportwirte auf Katzen übertragen.[8] Der Lungenhaarwurm ruft selten Krankheitserscheinungen hervor, nur bei stärkerem Befall kommt es – meist infolge bakterieller Begleitinfektionen – zu einer Bronchitis mit Husten.[7] Der Nachweis kann durch eine Kotuntersuchung auf Eier oder die Untersuchung von Lungenspülproben erfolgen.
Die Harnblasenhaarwürmer (Capillaria plica und Capillaria feliscati) besiedeln die Harnblase. Die Ausscheidung der Eier erfolgt über den Urin, der Nachweis einer Infektion ist demzufolge nur aus dem Urinsediment möglich. Harnblasenhaarwürmer können eine Blasenentzündung mit Harnabsatzstörungen, bei stärkerem Befall auch eine Blutarmut auslösen.[7]
Der Leberhaarwurm (Capillaria hepatica) parasitiert in der Leber und kann Abgeschlagenheit, Erbrechen, vermehrten Durst und Harnabsatz sowie Gelbsucht verursachen. Der Befall kann nur anhand einer Leberbiopsie mit anschließender feingeweblicher Untersuchung der Gewebsprobe gestellt werden.[7]
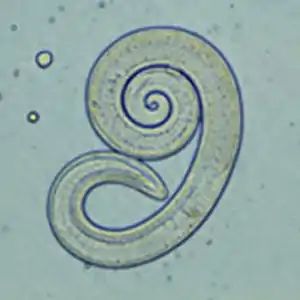
Trichinenbefall (Trichinellose)
Der Befall mit Trichinen (vor allem Trichinella spiralis) ist in Mitteleuropa bei Katzen sehr selten. Trichinen kommen weltweit vor und haben keine Entwicklungsphase in der Außenwelt. Die Infektion erfolgt durch Aufnahme larvenhaltigen Fleisches. Die Larven bohren sich in die Dünndarmwand und entwickeln sich dort zu den adulten Würmern. Die von den Weibchen abgegebenen Larven gelangen über Lymphe oder Blut in die Skelettmuskulatur, wo sie als Wartestadium die Infektionsquelle für andere fleisch- und allesfressende Tiere darstellen.
Ein geringer Trichinenbefall bleibt bei der Katze ohne Krankheitszeichen. Bei ausgeprägtem Befall können – wie beim Menschen (→ Trichinellose) – in der Phase der Darmbesiedlung zunächst Allgemeinstörungen, Erbrechen und blutiger Durchfall auftreten. Selten kommt es bei Katzen allerdings zu Muskelschwäche, Gangstörungen, Atemproblemen und Fieber durch eine Muskelentzündung infolge der in die Muskulatur eingewanderten Larven.
Herzwurmbefall (Dirofilariose)
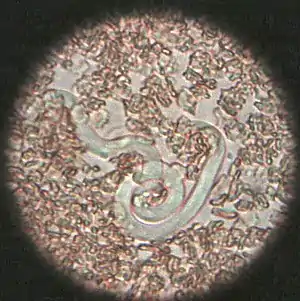
Die Infektion mit dem bis zu 30 cm langen Herzwurm (Dirofilaria immitis) ist bei Katzen selten, Hauptwirt für diesen Parasiten ist der Hund. In Mitteleuropa ist die Dirofilariose ohne Bedeutung, da der Parasit nur im Mittelmeerraum und den US-amerikanischen Südstaaten beheimatet ist. Die Erkrankung wird durch Stechinsekten übertragen, die als obligate Zwischenwirte fungieren. Sie nehmen beim Saugakt sogenannte Mikrofilarien aus dem Blut infizierter Tiere auf. In den Insekten findet die Entwicklung zur Larve L3 statt, die bei einem weiteren Saugakt auf ein neues Wirtstier übertragen wird. In der Unterhaut erfolgt die Entwicklung zur Larve L4. Diese wandert über die Blutgefäße in die Herzvorhöfe und die herznahen großen Gefäße und häutet sich zum adulten Herzwurm. Die Präpatenzzeit beträgt 8 Monate.
Der Herzwurm hat eine relativ hohe krankmachende Wirkung auf Katzen. Die Erkrankung zeigt sich in schlechtem Allgemeinbefinden, Durchfall und Husten. Sie kann durch Nachweis der 250 µm großen Mikrofilarien im Blutausstrich diagnostiziert werden, was bei Katzen aber schwierig und damit relativ unzuverlässig ist.
Nierenwurmbefall
Die Infektion mit dem Nierenwurm Dioctophyma renale ist nur in Südeuropa, Asien und Nordamerika anzutreffen und auch dort bei Katzen selten, der Hauptwirt sind Nerze. Der Nierenwurm ist mit bis zu einem Meter Länge der größte parasitisch lebende Fadenwurm und zeigt einen zweifachen Wirtswechsel: Erster Zwischenwirt sind Wenigborster, zweiter Süßwasserfische. Er parasitiert im Endwirt vor allem im Nierenbecken oder -fett. Der Befall einer Niere verläuft meist ohne Krankheitszeichen. Sind beide Nieren betroffen, können Nierenfunktionsstörungen infolge einer Hydronephrose oder Pyelonephritis auftreten. Die Infektion lässt sich durch eine Nierenbiopsie oder bildgebende Verfahren nachweisen. Die fassförmigen, gelbbraunen und 71–84 × 45–52 µm² großen Eier treten nur im Urinsediment auf, wenn ein weiblicher und männlicher Nierenwurm in einer Niere aufeinandertreffen.[9]
Infektionen durch Bandwürmer
Bei den Bandwurminfektionen muss zwischen dem Befall mit adulten Bandwürmern und dem Befall mit ihren Entwicklungsstadien unterschieden werden. Ersteres spielt bei Katzen die weitaus größere Rolle; die häufigsten Auslöser sind der Dickhalsige und der Gurkenkernbandwurm. Die Schadwirkung der adulten Bandwürmer ist gering, nur bei stärkerem Befall können aufgrund des Nährstoffentzugs Appetitlosigkeit, Abmagerung und struppiges Fell auftreten. Die aus dem Anus wandernden Glieder können Juckreiz und damit das sogenannte „Schlittenfahren“ (Rutschen auf dem Hinterteil) auslösen.
Befall mit dem Dickhalsigen Bandwurm
Der 15 bis 60 cm lange und etwa 5 mm breite Dickhalsige Bandwurm (Hydatigera oder Taenia taeniaeformis, auch Katzenbandwurm genannt) parasitiert im Dünndarm. Er ist ein bei Katzen häufiger Bandwurm, nur ausnahmsweise tritt er bei anderen Raubtieren auf. Die abgegebenen Bandwurmglieder verlassen mit dem Kot oder durch aktive Wanderung den Anus. Aus den eingetrockneten Gliedern werden in feuchtem Milieu die beschalten Onkosphären (reife Eier mit Larve L1, „Sechshakenlarve“) frei. Diese können durch Fliegen, Käfer und Schnecken verbreitet werden. Die beschalten Onkosphären werden von (obligaten) Zwischenwirten (Nagetiere, Eichhörnchen) aufgenommen und die freiwerdende Sechshakenlarve besiedelt vor allem die Leber des Zwischenwirts. Aus ihr entsteht die bereits bandwurmähnliche, bis zu 30 cm lange Finne (Strobilocercus fasciolaris), die beim Fressen des Zwischenwirts aufgenommen wird. Im Dünndarm angekommen, stülpt sich der Scolex aus und der Bandwurm saugt sich an der Darmschleimhaut fest. Die Präpatenz beträgt im Mittel fünf Wochen.
Im selben Tier sind zumeist nur zwei bis zehn Katzenbandwürmer anzutreffen, täglich scheiden sie etwa vier bis fünf Glieder aus. Diese länglich-trapezförmigen Gebilde sind unter Umständen bereits in der Analregion mit bloßem Auge sichtbar. Die etwa 35 µm großen beschalten Onkosphären lassen sich mittels Flotationsverfahren im Kot nachweisen. In einer Studie konnte bei Obduktionen eine Befallsrate von 25,9 % ermittelt werden, von denen nur 10 % im Flotationsverfahren beziehungsweise 27 % nach Zentrifugation erkannt wurden.[10] Zudem können die Eier morphologisch nicht von denen anderer Vertreter der Taeniidae (einschließlich des Fuchsbandwurms) unterschieden werden.
Befall mit dem Gurkenkernbandwurm
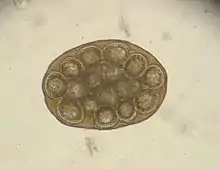
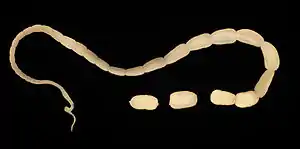
Der Gurkenkernbandwurm (Dipylidium caninum) – benannt nach seinen an einen Gurkenkern erinnernden Gliedern – ist bis zu 80 cm lang und parasitiert im vorderen Dünndarm. Als obligater Zwischenwirt fungiert vor allem der Katzenfloh, gelegentlich auch der Katzenhaarling. Die im Darm abgegebenen Bandwurmglieder verlassen mit dem Kot oder durch aktive Wanderung den Anus. Die Eier werden von den Larven der Insekten aufgenommen, durchdringen deren Darmwand und entwickeln sich im Fettkörper zum Finnenstadium (Zystizerkoid). Je nach Außentemperatur ist das Zystizerkoid bereits mit dem Schlüpfen des erwachsenen Flohs oder erst einige Tage später infektiös. Die Infektion erfolgt durch Fressen der Flöhe, worauf die Finne im Dünndarm zum adulten Bandwurm auswächst. Die Präpatenzzeit beträgt etwa drei Wochen.
Der Befall mit dem Gurkenkernbandwurm lässt sich durch den Nachweis der Glieder in der Analregion oder den Nachweis der 35–53 µm großen Eier oder von Eipaketen im Kot mittels Flotationsverfahren feststellen. Allerdings sind diese Nachweisverfahren sehr unsicher. In einer Studie konnte bei Obduktionen eine Befallsrate von 34,5 % ermittelt werden, obwohl alle vorherigen Kotuntersuchungen negativ ausfielen.[10]
Befall mit dem Fuchsbandwurm
Der Befall mit dem Fuchsbandwurm (Echinococcus multilocularis) ist bei Hauskatzen sehr selten (0,4 %), sie stellen einen Nebenwirt dar – als Hauptwirt fungieren Füchse. Da die Infektion mit diesem Parasiten aber für den Menschen lebensbedrohlich ist (siehe unten), ist auch die geringe Befallshäufigkeit von gesundheitspolitischer Bedeutung.
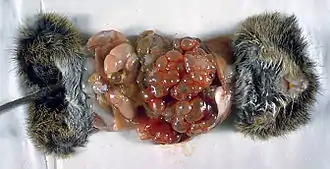
Der nur etwa drei Millimeter lange Fuchsbandwurm kommt auf der gesamten Nordhalbkugel vor. Er parasitiert im Dünndarm, zumeist im hinteren Drittel, und pflanzt sich tief zwischen die Darmzotten ein. Etwa alle zwei Wochen wird ein beschalte Onkosphären enthaltendes Bandwurmglied freigesetzt und über den Kot ausgeschieden. Die beschalten Onkosphären sind in der Umwelt sehr stabil, selbst Einfrieren und die meisten Desinfektionsmittel überstehen sie unbeschadet. Nur gegenüber Trockenheit, Temperaturen über 80 °C und Natriumhypochlorit sind sie empfindlich. Sie werden von Zwischenwirten (vor allem Nagetiere) aufgenommen und entwickeln sich in ihnen innerhalb von 40 bis 60 Tagen zu einem großen, schwammartigen Gewebe (Metazestode) mit den infektiösen Protoscolices. Die Infektion der Katze erfolgt über die orale Aufnahme der Zwischenwirte. Die Präpatenzzeit beträgt einen bis vier Monate.
Der Befall ruft bei Katzen zumeist keine Symptome hervor. Er kann anhand der beweglichen, etwa einen Millimeter langen Glieder im Kot oder der Analregion sowie bereits im Darm freigesetzter Onkosphären mittels Flotationsverfahren nachgewiesen werden. Letztere sind aber morphologisch nicht von denen der anderen Taeniidae zu unterscheiden. Eine einmalige Kotuntersuchung hat aufgrund der zyklischen Freisetzung nur eine Sicherheit von etwa 30 %. Weitere Möglichkeiten zur Diagnostik sind ein spezifischer ELISA für Kotproben und der DNA-Nachweis mittels PCR.[11] Nach den WHO-Richtlinien zur Bekämpfung dieses Parasiten müssen alle in der Diagnostik eingesetzten Gerätschaften und Materialien autoklaviert oder verbrannt werden.[12]
Selten vorkommende Bandwürmer
Infektionen mit anderen Taeniidae als dem Dickhalsigen Bandwurm sind bei Katzen selten. Der 30 bis 150 cm lange Taenia pisiformis (Hauptwirte: Hunde, Füchse) benötigt als Zwischenwirte Hasenartige und Nagetiere. Katzen sind für diesen Bandwurm ein wenig geeigneter Endwirt, er wird zumeist bereits vor der Bildung eihaltiger (gravider) Glieder von der Katze ausgeschieden. Der Befall mit dem 50 bis 250 cm langen Taenia hydatigena (Hauptwirte: Hunde und Füchse), als dessen Zwischenwirte Schweine, Wiederkäuer und Pferde dienen, sowie mit Taenia crassiceps (Zwischenwirte Hasenartige und Nagetiere) ist ebenfalls selten. Diese Vertreter rufen bei Katzen keine Krankheitserscheinungen hervor. Ihre medizinische Bedeutung liegt eher darin, dass ihre Eier morphologisch nicht von denen des Fuchsbandwurms zu unterscheiden sind, und dass Taenia hydatigena ein – wenn auch seltener – Zoonoseerreger ist.

Auch für den Fischbandwurm (Diphyllobothrium latum) sind Katzen ein wenig geeigneter Endwirt. Er wird in Katzen bis zu 1,5 m lang und 2 cm breit. Der Fischbandwurm benötigt zwei Zwischenwirte: Im ersten (Ruderfußkrebse) bildet sich das Procercoid, das für Säugetiere infektiöse Plerozerkoid in der Leibeshöhle und der Muskulatur von Fischen. Spirometra erinacei-europaei, ein weiterer Vertreter der Diphyllobothriidae, ist in Mitteleuropa sehr selten und kommt vor allem im Mittelmeerraum vor. Als erster Zwischenwirt fungieren ebenfalls Ruderfußkrebse, als zweiter Frösche, Schlangen und Vögel.
Neben dem Gurkenkernbandwurm können bei Katzen weitere Vertreter der Familie Dipylidiidae vorkommen. Diese sind jedoch vorwiegend im Mittelmeerraum anzutreffen, lediglich Joyeuxiella pasqualei wurde mittlerweile auch in Deutschland beobachtet. Sein Zwischenwirt sind Dungkäfer (Aphodiidae), in die Infektionskette können aber auch Transportwirte wie Reptilien und kleine Säugetiere eingeschaltet sein. Er ist bis zu 50 cm lang. Joyeuxiella echinorhynchoides ist nur etwa halb so lang, seine Infektionskette entspricht der von J. pasquallei. Diplopylidium noelleri und Diplopylidium acanthotretum sind etwa 12 cm lang und benötigen als Zwischenwirt Dungkäfer oder Flöhe.
Der Befall mit Vertretern der Gattung Mesocestoides ist – obwohl in Mitteleuropa heimisch – bei Katzen sehr selten. Ihr erster Zwischenwirt sind vermutlich Moosmilben,[7] als zweiter dienen je nach Spezies Reptilien, Vögel und Säugetiere.
Befall mit Finnenstadien
Finnenstadien sind bei Katzen sehr selten anzutreffen. Sie schädigen das Tier durch ihr raumforderndes Wachstum mit Zerstörung befallener Organe.
Das reiskornähnliche Finnenstadium (Tetrathyridium) von Mesocestoides leptothylacus kann selten auch bei Katzen auftreten. Der eigentliche zweite Zwischenwirt sind Feldmäuse. Bei starkem Befall kann es zu schweren Krankheitsbildern mit starker Abnahme (Kachexie) und Todesfällen infolge einer Bauchfellentzündung kommen. Durch das Coenurus von Taenia serialis sowie den Cysticercus von Taenia crassiceps[13] wurden infolge einer Schädigung des Gehirns zentralnervöse Störungen (ähnlich der Coenurose der Schafe) beobachtet.
Weitere bei Katzen auftretende Finnenstadien sind die Metazestode des Dreigliedrigen Hundebandwurms (Echinococcus granulosus), das Sparganum von Spirometra mansonoides und der Cysticercus des Schweinebandwurms (Taenia solium). Zumeist rufen sie aber keine Krankheitssymptome hervor, sondern werden als Nebenbefund bei Obduktionen entdeckt.
Infektionen durch Saugwürmer
Infektionen durch Saugwürmer (Trematoda) sind in Mitteleuropa selten und verlaufen im Allgemeinen ohne Krankheitszeichen. Sie sind durch den Nachweis der Eier im Kot feststellbar.
Leberegelbefall
Die bei Katzen vorkommenden Leberegel (Opisthorchis felineus, Pseudoamphistomum truncatum und Metorchis bilis) benötigen für ihre Entwicklung einen zweifachen Wirtswechsel. Als erster Zwischenwirt dienen Wasserschnecken, als zweiter Süßwasserfische. Katzen infizieren sich durch die Aufnahme von Fischen. Die eingekapselten (enzystierten) Metazerkarien in Fischen sind sehr widerstandsfähig und werden nur durch Kochen sicher abgetötet. In seltenen Fällen kann der Befall mit Leberegeln eine Darmentzündung mit Durchfall, ein gestörtes Allgemeinbefinden und Leber- und Bauchspeicheldrüsenveränderungen hervorrufen.
Darmegelbefall
Bei Katzen kommen verschiedene Darmegel vor, deren Entwicklung wie bei den Leberegeln über zwei Zwischenwirte erfolgt. Der erste Zwischenwirt ist stets eine Süßwasserschnecke. Der zweite Zwischenwirt – und damit die Infektionsquelle für Katzen – variiert je nach Parasitenart: Bei Alaria alata sind es Kaulquappen, Reptilien, Vögel und Säugetiere, bei Metagonimus yokogawai und Apophallus donicus Fische, bei Isthmiophora melis Fische und Amphibien und bei Echinochasmus perforans Kaulquappen und Fische. Ein Darmegelbefall ruft nur selten Krankheitserscheinungen wie Durchfall hervor.
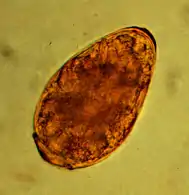
Lungenegelbefall
Lungenegel (in Asien vor allem Paragonimus westermani, in Amerika vor allem P. kellicotti) spielen in Europa keine Rolle. Erster Zwischenwirt sind Wasserschnecken, der zweite Süßwasserkrabben und Krebse. Die Infektion erfolgt durch Aufnahme roher Schalentiere. Lungenegel wurden in Thailand recht häufig bei Tigern und Leoparden, dagegen nicht bei Bengalkatzen nachgewiesen.[14] In Amerika kommen sie sowohl bei Hauskatzen[15] als auch Wildtieren[16] vor. Die im Darm frei werdenden Metazerkarien wandern in die Lunge, wo sie sich in Zysten zu den adulten Egeln entwickeln. Die Eier werden – wie bei den übrigen Lungenwürmern – hochgehustet und gelangen über den Kot in die Umwelt.
Der Befall mit Lungenegeln kann symptomlos bleiben, aber auch Atemprobleme auslösen, die denen des Katzenasthmas gleichen. Durch Platzen der Zysten kann ein Pneumothorax mit akuter Atemnot entstehen. Der Nachweis der Infektion kann durch Kotuntersuchungen auf Eier, mittels Lungenspülproben oder mittels Röntgenbild der Lunge erfolgen.[15]
Befallshäufigkeit und ihre Einflussfaktoren
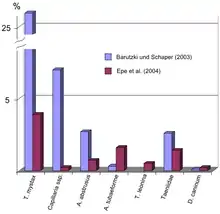
Die Befallshäufigkeit ist je nach Wurmart sehr unterschiedlich. In einer deutschen Studie an 3167 Hauskatzen wurde mittels Flotationsverfahren bei 24 % der Tiere Endoparasiten nachgewiesen, wobei T. mystax mit 26 % die höchste Befallsrate aufwies.[17] Eine andere Studie an 441 Kotproben wies T. mystax nur bei 3,9 % der Proben nach, aber auch hier war dieser Spulwurm der häufigste Parasit.[18] Auch in Belgien[19], den Niederlanden[20], dem Vereinigten Königreich[21], den Vereinigten Staaten[22][23], Australien[24] und Nigeria[25] dominiert der Befall mit T. mystax, die Befallsraten liegen hier bei bis zu 60 %. In Katar wurden bei streunenden Katzen dagegen vor allem Bandwürmer (T. taeniaeformis: 76 %, Dipylidiidae: 43 %) beobachtet, T. mystax nur bei 0,4 % der Tiere.[26]
Es gibt zahlreiche Einflussfaktoren auf den Befall mit Würmern. Wildtiere sind in der Regel deutlich häufiger betroffen als Katzen in menschlicher Obhut, da letztere häufig regelmäßig entwurmt werden. Auch bei Hauskatzen gibt es deutliche Unterschiede zwischen reinen Wohnungskatzen und solchen mit Freigang oder streunenden, da von letzteren häufiger Nagetiere oder Fische aufgenommen werden, die als Zwischen- oder Transportwirte eine Infektionsquelle darstellen. Darüber hinaus fressen verwilderte Haus- und Wildkatzen aus Hunger gelegentlich Erbrochenes von anderen Katzen, so dass der Magenwurmbefall bei ihnen deutlich häufiger auftritt. Streunende Katzen in Spanien wiesen zu fast 90 % einen Befall mit Magen-Darm-Würmern auf.[27] Katzen in größeren Beständen wie Tierheimen oder Laborhaltungen sind aufgrund des engeren Kontakts mit potentiellen Wurmträgern deutlich häufiger betroffen.[22][28] Bei Kotuntersuchungen an Groß- und anderen Wildkatzen konnten je nach Spezies bei 66 bis 100 % der Tiere Wurmeier oder -larven nachgewiesen werden.[14][16]
Neben global vorkommenden Parasiten wie T. mystax haben einige ein beschränktes Verbreitungsgebiet. Dies kann in geografischen oder klimatischen Bedingungen und dem Vorkommen geeigneter Zwischenwirte begründet sein. So ist beispielsweise der Katzenleberegel (Opisthorchis felineus) in Asien sowie Süd- und Osteuropa häufiger, in Deutschland vor allem im östlichen Brandenburg verbreitet, wo eine Befallshäufigkeit von 16 % ermittelt wurde.[29] Der Fischbandwurm tritt in Deutschland vor allem entlang der großen Flüsse sowie in den Küstenregionen, in der Schweiz an den großen Seen auf. Die meisten Dipylidiidae sind ausschließlich in Südeuropa anzutreffen.
Diagnostik
| Material | Parasit |
|---|---|
| Kot (Flotation) | Spul-, Haken-, Magen-Darm-Haarwürmer adulte Bandwürmer Leber-, Lungen und Darmegel |
| Kot (Auswanderung) | Lungenwürmer |
| Mageninhalt | Magenwürmer |
| Gewebsproben | Trichinen (Muskel) Leberhaarwurm (Leber) Nierenwurm (Niere) |
| Blut | Herzwurm |
| Urin | Harnblasenhaarwürmer Nierenwurm |
Über die tatsächlichen Befallsraten in den Gesamtpopulationen der verschiedenen Katzenarten gibt es kaum zuverlässige Daten. Klinisch lassen sich nur die wenigsten Wurminfektionen – beispielsweise beim Vorkommen von Spulwürmern im Erbrochenen oder von Bandwurmgliedern in der Analregion – nachweisen.
Für die meisten Katzenarten gibt es gar keine oder allenfalls Einzelstudien an regional begrenzten Populationen. Die meisten Studien beruhen auf Kotuntersuchungen bei Hauskatzen. Eine Reihe von Wurminfektionen kann aber mit dieser Untersuchungsmethode nicht aufgedeckt werden oder der Nachweis ist infolge einer zyklischen Ausscheidung wie beim Fuchs- und Gurkenkernbandwurm nur unsicher. Gegebenenfalls müssen mikroskopische Verfahren durch aufwendige molekularbiologische ergänzt werden, um beispielsweise Eier der Taeniidae voneinander abzugrenzen.
Die wenigen Erhebungen anhand von Obduktionen[19][26][27] basieren nicht auf Zufallsstichproben, sondern auf eingesendetem Material von verstorbenen Tieren. Vor allem für den Befall mit Finnenstadien von Bandwürmern ist die Obduktion – wenn man von wenigen aufwendigen bildgebenden Verfahren absieht – das einzig sichere Nachweisverfahren.
Bekämpfung
Eine vollständige Eliminierung der Wurminfektionen bei Katzen ist unmöglich. Die Entwicklungszyklen der Parasiten lassen sich nicht unterbinden, da über freilebende Katzen oder andere Wirte stets neue Parasitengenerationen nachwachsen. Auch die Bekämpfung eventueller Zwischenwirte ist kaum praktikabel und ökologisch nicht vertretbar. Die unschädliche Beseitigung von Katzenkot ist eine hygienische Maßnahme, die zumindest zu einer Erregerverdünnung führt. Kot sollte täglich eingesammelt und über den Hausmüll entsorgt werden, denn Spulwurmeier sind im feuchten Mileau bis zu vier Jahre, Peitschenwurmeier über sechs Jahre und Bandwurmeier sechs Monate infektiös. Die Eier haben eine hohe Tenazität. Fußböden können mit einem Dampfreiniger mit über 60 °C effektiv gereinigt werden, Katzentoiletten mit kochendem Wasser. Auf eine gute anschließende Trocknung sollte geachtet werden. Die meisten Desinfektionsmittel sind nicht gegen Fadenwurmeier wirksam, auch Handdesinfektionsmittel nicht, weshalb beim Umgang mit Kot Handschuhe getragen werden sollten.[30]
Die Behandlung von Wurminfektionen beschränkt sich zumeist auf die in menschlicher Obhut gehaltenen Katzen. Die meisten Infektionen sind für Katzen eher harmlos, da sich bei intaktem Immunsystem ein Erreger-Wirt-Gleichgewicht einstellt. Da aber einige von ihnen gesundheitliche Störungen auslösen können und einige auch eine potentielle Gefahr für den Menschen darstellen, sind regelmäßige Wurmkuren bei Katzen im menschlichen Umfeld durchaus sinnvoll. Der European Scientific Counsel Companion Animal Parasites (ESCCAP) – die europäische Vereinigung der Fachleute für Parasiten bei Haustieren – hat daher Empfehlungen für die Bekämpfung der Wurminfektionen herausgegeben. Diese werden durch nationale tiermedizinische Fachgesellschaften an regionale Besonderheiten angepasst. In den Vereinigten Staaten gibt es ebenfalls solche Leitlinien, die hier vom Companion Animal Parasite Council (CAPC) herausgegeben werden.
Die zuletzt im Januar 2008 nach den ESCCAP-Richtlinien für Deutschland angepassten Empfehlungen zielen darauf, Katzen „… durch eine fachgerechte Diagnostik, Therapie und Prävention vor Infektionen mit Würmern und deren Folgen zu schützen“.[31] Eine zielgerichtete Bekämpfung wird vor allem für Spul-, Haken- und Fuchsbandwürmer empfohlen. Die Herzwurmbekämpfung spielt in Mitteleuropa nur eine Rolle bei den Katzen (und Hunden), die in den Mittelmeerraum verbracht werden sollen oder von dort stammen.

Katzenwelpen sollten bei einem Toxocara-Befall der Mutter ab einem Alter von drei Wochen mit einem geeigneten Wurmmittel (Anthelminthikum) behandelt werden und anschließend in zweiwöchigem Abstand bis zwei Wochen nach dem Absetzen. Auch die Katzenmutter sollte nach der Geburt behandelt werden, da schlummernde Toxocara-Larven in dieser Zeit aktiviert werden. Eine sichere Prophylaxe gegen T. mystax bietet nur eine monatliche Behandlung, die allerdings nur für Katzen in größeren Haltungen oder mit Kontakt zu Kleinkindern erwogen werden sollte. Generell wird eine vierteljährliche prophylaktische Entwurmung vorgeschlagen.[31] Für die Behandlung gegen Spulwürmer sind in Deutschland für Hauskatzen Arzneimittel auf der Basis von Emodepsid, Fenbendazol, Flubendazol, Mebendazol, Milbemycinoxim, Moxidectin, Pyrantel und Selamectin zugelassen. Diese Arzneistoffe sind Breitbandanthelminthika und entfalten eine Wirkung auch gegen die meisten anderen bei Katzen vorkommenden Fadenwürmer, die im Einzelfall aber auch fehlend oder unzureichend sein kann. Zum Schutz vor Herzwürmern sind von diesen Stoffen nur Moxidectin, Milbemycinoxim und Selamectin wirksam.[32] Magenwürmer werden von keinem dieser Wirkstoffe erfasst, hier sind in Deutschland keine für Katzen zugelassenen Präparate auf dem Markt, so dass andere Tierarzneimittel auf der Basis von Levamisol oder Ivermectin umgewidmet werden müssen. Beim Nierenwurmbefall ist nur die Entfernung der betroffenen Niere möglich.
Für die Bekämpfung des in ganz Mittel- und Osteuropa heimischen Fuchsbandwurms – für dessen Verbreitung Katzen allerdings nur eine geringe Bedeutung haben – wird empfohlen, kein rohes Fleisch oder Schlachtabfälle zu verfüttern. Bei Freigängern beziehungsweise Katzen, die Nagetiere jagen ist eine regelmäßige Kotuntersuchung oder monatliche prophylaktische Behandlung gegen Bandwürmer angezeigt. Wichtig ist, dass jedes Vorkommen morphologisch gleicher Bandwurmeier (Taeniidae) diagnostisch in einem Speziallabor abzuklären ist. Bei einem positiven Nachweis müssen rigide Hygienemaßnahmen wie Baden unter Schutzkleidung und strikte unschädliche Beseitigung des Kots erfolgen.[12] Zur Behandlung und Prophylaxe des Fuchsbandwurms werden Praziquantel oder Epsiprantel eingesetzt, Praziquantel ist auch gegen die anderen Plattwürmer wirksam.[31] Einige europäische Länder wie das Vereinigte Königreich, Irland, Malta, Finnland, Schweden oder Norwegen verlangen eine im EU-Heimtierausweis dokumentierte prophylaktische Behandlung gegen den Fuchsbandwurm als Einreisevoraussetzung.
Gefahren für den Menschen
Einige der bei Katzen auftretenden Würmer sind auf den Menschen übertragbar, also Zoonoseerreger.
Die größte Gefährdung für den Menschen stellt der Fuchsbandwurm (Echinococcus multilocularis) dar. Er ruft das Krankheitsbild der alveolären Echinokokkose hervor, das durch eine kleinblasige Zerstörung innerer Organe – befällt in >99,9 % die Leber – gekennzeichnet ist und unbehandelt zumeist tödlich endet. Allerdings ist diese Erkrankung sehr selten, und Katzen spielen, da der Bandwurm bei ihnen kaum vorkommt, bei der Verbreitung dieses Parasiten nach Meinung der meisten Autoren keine Rolle.[33] In einer österreichischen Studie an 21 Patienten erwies sich der Besitz von Katzen jedoch als Risikofaktor für diese Erkrankung.[34]
Von den Spulwürmern ist Toxocara mystax als Schmierinfektion auf den Menschen übertragbar. Häufigste Ansteckungsquelle sind bei Kleinkindern mit Katzenkot verunreinigte Sandkästen. Die Infektion entspricht der eines Transportwirtes und verläuft – im Gegensatz zur Ansteckung mit dem Hundespulwurm – meist klinisch unauffällig. Die Larven können auch beim Menschen in innere Organe oder die Muskulatur wandern (sogenannte Larva migrans visceralis). Gelegentlich können durch solche Wanderlarven Augenschäden, zentralnervöse Erscheinungen (Kopfschmerz, Verhaltensstörungen), Lebervergrößerung, Bronchitis mit Husten oder bei Kindern auch allergische Reaktionen wie Nesselsucht auftreten. Auch die bei Katzen eher seltenen Fadenwürmer wie A. caninum, C. hepatica und der Nierenwurm können als Wanderlarven innere Organe des Menschen befallen.[35] Für die Verbreitung der Trichinellose spielen Katzen keine Rolle, da Trichinen bei ihnen selten sind und Katzen normalerweise nicht von Menschen gegessen werden.
Der Gurkenkernbandwurm kann selten auch Erkrankungen bei Kindern verursachen, wenn diese – zumeist versehentlich – infizierte Flöhe verschlucken (→ Dipylidiasis). Der Mensch fungiert hier wie die Katze als Endwirt, eine direkte Ansteckung von einer Katze ist nicht möglich. Zudem spielt der Haushund bei der Verbreitung dieses Bandwurms die weitaus größere Rolle. Auch die anderen Vertreter der Dipylidiidae sind Zoonoseerreger.
Der Katzenleberegel kann in seltenen Fällen auch auf den Menschen übergehen. Die Infektion erfolgt aber nicht durch Katzen, sondern durch Aufnahme metazerkarienhaltiger Fische. Neben Katzen spielen Fischotter und Füchse als Endwirte eine Rolle bei der Aufrechterhaltung der Parasitenpopulation. Auch Darmegel sind für den Menschen pathogen, allerdings spielen Katzen für die Verbreitung dieser Parasiten kaum eine Rolle, die Infektion erfolgt bei Alaria alata zumeist über Schweinefleisch (Schweine fungieren als Transportwirte). Gleiches gilt für die Verbreitung der Lungenegel wie Paragonimus westermani – der Mensch infiziert sich über die Aufnahme roher Schalentiere.
Zum Schutz vor zoonotischen Wurminfektionen empfiehlt die ESCCAP[31]:
- Hygienemaßnahmen wie Händewaschen oder Gartenarbeit mit Handschuhen,
- kein Verzehr von ungewaschenen Pflanzen (Gemüse, Früchte und Pilze),
- regelmäßige parasitologische Untersuchungen oder prophylaktische Entwurmungen der Katzen,
- regelmäßiges Beseitigen von Katzenkot (dies ist bei Freigängern und wildlebenden Katzen aber nicht praktikabel) sowie
- Vermeiden potentiell mit Wurmstadien kontaminierter Umgebungen (Hundewiesen, Gärten oder Spielplätze, Sandkästen), insbesondere für Kinder.
Literatur
- Johannes Eckert: Lehrbuch der Parasitologie für die Tiermedizin. 2. Auflage. Enke-Verlag, Stuttgart 2008, ISBN 978-3-8304-1072-0.
- Theodor Hiepe, Regine Ribbeck: Lehrbuch der Parasitologie. Band 4. Fischer-Verlag, Stuttgart 1982, ISBN 3-437-20252-9.
- Regine Ribbek, Steffen Rehbein: Krankheiten der Katze. Hrsg.: Marian C. Horzinek. 4. Auflage. Enke-Verlag, Stuttgart 2005, ISBN 3-8304-1049-2, „Helminthosen“, S. 207–226.
- Thomas Schnieder (Hrsg.): Veterinärmedizinische Parasitologie. 6. Auflage. Parey-Verlag, Stuttgart 2006, ISBN 978-3-8304-4135-9.
Einzelnachweise
- ESCCAP: Bekämpfung von intestinalen Protozoen bei Hunden und Katzen. In: Kleintierpraxis 58 (2013), S. 416–430.
- D.B. Pence et al.: Helminths of the ocelot from southern Texas. In: J Wildl Dis. 39 (2003), S. 683–689. PMID 14567231
- K.L. Tiekotter: Helminth species diversity and biology in the bobcat, Lynx rufus (Schreber), from Nebraska. In: J Parasitol. 71 (1985), S. 227–234. PMID 3998960
- A.M. Hargis et al.: Ollulanus tricuspis found by fecal flotation in a cat with diarrhea. In: J. Am. Vet. Med. Assoc. 182 (1983): S. 1122–1123.
- Binke Dürr: Feinnadelaspiration der Lunge bei zwei Katzen mit Aelurostrongylus-abstrusus-Infektion. In: Kleintierpraxis 54 (2009), S. 88–92.
- D. K. Curtsinger et al.: Gastritis caused by Aonchotheca putorii in a domestic cat. In: J Am Vet Med Assoc. 203 (1993), S. 1153–1154. PMID 8244862
- Frank Dieffenbacher: Untersuchung zur Parasitenfauna von verwilderten Hauskatzen und deren Behandlung mit Selamectin und Praziquantel. Vet. Med. Diss., FU Berlin, 2007. (online-Version)
- Heinz Sager: Lungenwürmer, Capillaria aerophila. In: Katzen Magazin 1/2007 (Online-Version)
- Giant Kidney Worm Infection in Mink and Dogs. merckvetmanual.com (Memento des Originals vom 3. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- C. Adolph et al.: Prevalence of Dipylidium caninum and Taenia taeniaeformis in cats. In: AAVP Abstracts 2011
- P. Deplazes et al.: Echinococcus multilocularis coproantigen detection by enzyme-linked immunosorbent assay in fox, dog, and cat populations. In: J Parasitol. 85 (1999), S. 115–121. PMID 10207375
- J. Eckert et al.: WHO/OIE Manual on Echinococcosis in Humans and Animals: a Public Health Problem of Global Concern. World Organisation for Animal Health and World Health Organization, 2001. ISBN 92-9044-522-X (pdf)
- A. Wunschmann et al.: Cerebral cysticercosis by Taenia crassiceps in a domestic cat. In: Journal of Veterinary Diagnostic Investigation 15 (2003), S. 484–488.
- S. Patton und A.R. Rabinowitz: Parasites of wild felidae in Thailand: a coprological survey. In: J Wildl Dis. 30(1994), S. 472–475. PMID 7933301
- Eleanor C. Hawkins: Pulmonary parasites. In: Richard W. Nelson und C. Guillermo Couto: Small Animal Internal Medicine. Mosby, 3. Aufl., S. 302–303. ISBN 0-323-01724-X
- S. Patton et al.: A coprological survey of parasites of wild neotropical felidae. In: J Parasitol. 72 (1986), S. 517–520. PMID 3783346
- D. Barutzki und R. Schaper: Endoparasites in dogs and cats in Germany 1999-2002. In: Parasitol Res. 90 (2003), Suppl 3, S148–S150. PMID 12928886
- C. Epe et al.: Ergebnisse parasitologischer Kotuntersuchungen von Pferden, Wiederkäuern, Schweinen, Hunden, Katzen, Igeln und Kaninchen in den Jahren 1998–2002. In: Dtsch. Tierärztl. Wochenschr. 111 (2004), S. 243–247. PMID 15287577
- O. Vanparijs et al.: Helminth and protozoan parasites in dogs and cats in Belgium. In: Vet Parasitol. 38 (1991), S. 67–73. PMID 2024431
- P.A. Overgaauw: Prevalence of intestinal nematodes of dogs and cats in The Netherlands. In: Vet Q. 19 (1997), S. 14–17. PMID 9225423
- S. Nichol et al.: Prevalence of intestinal parasites in domestic cats from the London area. Vet Rec. 109 (1981), S. 252–253. PMID 7340062
- W.M. Guterbock und N.D. Levine: Coccidia and intestinal nematodes of East Central Illinois cats. In: J Am Vet Med Assoc. 170 (1977), S. 1411–1413. PMID 873847
- C.V. Spain et al.: Prevalence of enteric zoonotic agents in cats less than 1 year old in central New York State. In: J Vet Intern Med. 15 (2001), S. 33–38. PMID 11215908
- C.S. Palmer et al.: National study of the gastrointestinal parasites of dogs and cats in Australia. In: Vet Parasitol. 151 (2008), S. 181–190. PMID 18055119
- N. Umeche und A.E. Ima: Intestinal helminthic infections of cats in Calabar, Nigeria. In: Folia Parasitol (Prag) 35 (1988), S. 165–168. PMID 3169644
- M.A. Abu-Madi et al.: Descriptive epidemiology of intestinal helminth parasites from stray cat populations in Qatar. In: J Helminthol. 82 (2008), S. 59–68. PMID 18199386
- C. Calvete et al.: Gastrointestinal helminth parasites in stray cats from the mid-Ebro Valley, Spain. In: Vet Parasitol. 28 (1998), S. 235–240. PMID 9637225
- G. Miró et al.: Prevalence of antibodies to Toxoplasma gondii and intestinal parasites in stray, farm and household cats in Spain. In: Vet Parasitol. 126 (2004), S. 249–255. PMID 15567588
- R. Schuster et al.: Untersuchungen zur Endoparasitenfauna der Hauskatze in Ostbrandenburg. In: Berl Münch Tierarztl Wochenschr 110 (1997), S. 48–50
- Barbara Henney und Anja Joachim: Grundlagen der Koproskopie und der Besitzerhaltung zu Helminthen bei Hunden und Katzen. In: Kleintierpraxis Band 66, 2021, Nummer 8, S. 466–481.
- ESCCAP-Empfehlungen Bekämpfung von Würmern (Helminthen) bei Hunden und Katzen. Deutsche Adaption der ESCCAP-Empfehlung. (pdf)
- Vetidata-Liste in Deutschland für Hunde und Katzen zugelassener Wurmmittel (pdf (Memento vom 21. November 2008 im Internet Archive))
- P. Deplazes: Ecology and epidemiology of Echinococcus multilocularis in Europe. In: Parassitologia. 48 (2006), S. 37–39. PMID 16881392
- P. Kreidl et al.: Domestic pets as risk factors for alveolar hydatid disease in Austria. In: Am J Epidemiol. 147 (1998), S. 978–981. PMID 9596476
- Paul C. Beaver: Larva migrans. In: Experimental Parasitology 5 (1956), S. 587–621.