Alveoläre Echinokokkose
Die alveoläre Echinokokkose ist eine sich ausbreitende, aber dennoch seltene Parasitenerkrankung des Menschen. Sie wird durch das Larvenstadium des Fuchsbandwurms (Echinococcus multilocularis) verursacht und verläuft unbehandelt meist tödlich. Der Mensch stellt einen Fehlzwischenwirt dar, da der Entwicklungszyklus des Fuchsbandwurms nicht über ihn hinausgeht.[1]
| Klassifikation nach ICD-10 | |
|---|---|
| B67.5 | Echinococcus-multilocularis-Infektion [alveoläre Echinokokkose] der Leber |
| B67.6 | Echinococcus-multilocularis-Infektion an mehreren und sonstigen Lokalisationen |
| B67.7 | Echinococcus-multilocularis-Infektion, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Neben der alveolären Echinokokkose gibt es weitere Erkrankungen des Menschen durch Echinokokken. Die zystische Echinokokkose wird vom Hundebandwurm übertragen und stellt weltweit etwa 90 Prozent der Fälle humaner Echinokokkosen. Erreger der in Süd- und Mittelamerika sehr selten auftretenden polycystischen Echinokokkose sind Echinococcus vogeli, ein Parasit einheimischer Wildhunde, und E. oligarthra, der als Hauptwirt Katzen befällt.[2][3]
Erreger
Die alveoläre Echinokokkose wird durch eine Infektion mit dem ersten Larvenstadium des Fuchsbandwurms (Echinococcus multilocularis, syn. E. alveolaris) hervorgerufen. Der Fuchsbandwurm ist mit nur wenigen Millimetern Länge ein sehr kleiner Vertreter der Bandwürmer, von denen einzelne Arten mehrere Meter lang werden können.[4] Sein Verbreitungsgebiet reicht über die gemäßigten bis kalt-gemäßigten Klimazonen der Nordhalbkugel. In Europa liegt sein Verbreitungsschwerpunkt in Mitteleuropa, vor allem in Teilen von Deutschland, Österreich, der Schweiz und Frankreich, wo es inselartige Bereiche mit sehr hoher Populationsdichte innerhalb großer Gebiete ohne oder mit geringer Häufigkeit gibt. Seit Ende des 20. Jahrhunderts findet eine Ausbreitung statt, insbesondere in Richtung Westeuropa und Osteuropa.[5][6]
Der Fuchsbandwurm infiziert als Hauptwirte vor allem Angehörige der Gattung Vulpes, in Mitteleuropa, Asien und Nordamerika den Rotfuchs (Vulpes vulpes) und in den zirkumpolaren Regionen den Polarfuchs (Vulpes lagopus). In Nordamerika spielt der Kojote (Canis latrans) als Wirt eine bedeutende Rolle und in China der Haushund. Als Zwischenwirt dienen kleine Säugetiere, vor allem Wühlmäuse, die in Deutschland die häufigsten Zwischenwirte sind. Beim Menschen handelt es sich um einen Fehlzwischenwirt, da der Lebenszyklus des Parasiten mit dem Tod seines Wirts erlischt.[5]
Vorkommen
Das Auftreten der alveolären Echinokokkose ist, abgesehen von der Möglichkeit der Einreise bereits infizierter Patienten, an die geographische Verbreitung des Fuchsbandwurms gebunden. So treten Erkrankungen nur in verschiedenen Regionen der nördlichen Hemisphäre auf, namentlich in Mitteleuropa, den USA, Zentralasien, Sibirien, China und Japan. Der seit dem Ende des 20. Jahrhunderts beobachteten Ausbreitung des Fuchsbandwurms folgt die alveoläre Echinokokkose, sie gilt als eine Emerging Infectious Disease.[7]
Die höchste weltweit jemals festgestellte Erkrankungsrate wurde mit 6,2 Prozent zwischen 2000 und 2002 bei einer Reihenuntersuchung mit 3200 Teilnehmern in Sêrxü, einem Kreis der chinesischen Provinz Sichuan, ermittelt. Dabei schwankte die Prävalenz in den untersuchten Dörfern zwischen 0 und 14,3 Prozent. Die Bevölkerung der Region ist einer Kombination mehrerer Risikofaktoren ausgesetzt, als Erklärung für die in einem kleinen Gebiet von Dorf zu Dorf extrem schwankende Zahl Erkrankter werden lokal stark schwankende Zahlen beobachteter Nagetiere herangezogen.[7]
In anderen Regionen, so auch in Mitteleuropa, ist die Erkrankung sehr selten. Im Rahmen einer Erhebung des Europäischen Echinokokkoseregisters wurden aus acht Staaten der Europäischen Union (seinerzeit Belgien, Deutschland, Frankreich, Griechenland, Großbritannien, Italien, die Niederlande und Österreich) sowie der Schweiz, Polen, Tschechien und der Türkei für den Zeitraum von 1982 bis 2000 lediglich 559 Fälle der alveolären Echinokokkose ermittelt. Fast alle ortständigen (autochthonen) Fälle wurden aus Deutschland (132), Österreich (54), der Schweiz (118) und Frankreich (235) gemeldet, das sind Länder, in denen der Fuchsbandwurm seit jeher gebietsweise häufig auftritt. In Deutschland kann ein großer Anteil nicht bekannt gewordener Erkrankungen aufgetreten sein, da es im Untersuchungszeitraum noch keine Meldepflicht für die Erkrankung gab und die Erfassung auf freiwilligen Meldungen behandelnder Ärzte beruhte.[8] 2015 wurden für Deutschland 44 Fälle gemeldet, 2016 waren es 26, 2017 gab es 36 Fälle Erkrankungen, 2018 wurden 49 Fälle gemeldet.
In der Schweiz, in der bis 1997 eine Meldepflicht für humane Echinokokkosen bestand, wurden über einen Zeitraum von 50 Jahren, von 1956 bis 2005, nur 494 Fälle der alveolären Echinokokkose bekannt. Die Anzahl der jährlichen Neuerkrankungen pro 100.000 Einwohner schwankte in den Jahren von 1956 bis 2000 zwischen 0,10 und 0,15 und stieg im Zeitraum 2001 bis 2005 auf 0,26 an. Dabei kann eine hohe Dunkelziffer für die ersten Jahrzehnte ausgeschlossen werden, da der Fortschritt in der Diagnostik während des Beobachtungszeitraums lediglich frühere Diagnosen bewirkte. Die Zunahme folgte in einem Abstand von etwa 15 Jahren, der angenommenen Inkubationszeit, dem in der Schweiz und ganz Mittel- und Osteuropa beobachteten Anstieg der Fuchspopulation.[9]
Übertragung
Die infektiösen Bandwurmeier werden von infizierten Hauptwirten, vorrangig Füchsen und Hunden, aber in geringerem Maß auch von Hauskatzen, mit ihrem Kot ausgeschieden. Die Eier überdauern in der Umwelt lange Zeit, sie sind mit einem Durchmesser von 30 bis 40 µm mikroskopisch klein und im Alltag nicht zu erkennen. Menschen können sich nur durch das Verschlucken von Eiern des Fuchsbandwurms mit dem Erreger infizieren.
Die Eier können beim Kontakt mit kontaminierter Erde und insbesondere mit infizierten Füchsen, Hunden oder Katzen aufgenommen werden, an deren Fell sie haften. Es ist nicht klar, ob eine Übertragung auch durch kontaminierte Beeren, Pilze oder Wasser[10] oder das Einatmen von belastetem Staub, beispielsweise bei der Heuernte, stattfinden kann.[11] Das Robert Koch-Institut hält aufgewirbelten Staub für kaum oder überhaupt nicht infektiös, da im Fall des Einatmens die Aktivierung des Parasiten durch das Magenmilieu ausbleiben würde und Bandwurmeier empfindlich gegen Austrocknung sind.
Es wird davon ausgegangen, dass bei den meisten Fällen erst eine mehrfache Exposition zur Infektion führt, und keine einmalige Aufnahme der Bandwurmeier. Eine Übertragung der Erkrankung von Mensch zu Mensch ist nicht möglich.
Im Rahmen der oben genannten Studie des Europäischen Echinokokkoseregisters über Krankheitsfälle in Europa konnten für 210 der 559 Patienten Informationen über mögliche Risikofaktoren ausgewertet werden. Etwa 22 Prozent der Patienten waren Landwirte, 46 Prozent der nicht beruflich in der Landwirtschaft tätigen Patienten übten in ihrer Freizeit Gartenarbeiten oder ähnliche Beschäftigungen aus. 70 Prozent der Patienten waren zumindest in der Vergangenheit Halter von Hunden oder Katzen. Nur sieben Prozent der Erkrankten hatten weder eine landwirtschaftliche Tätigkeit oder Gartenarbeiten ausgeübt, noch Haustiere gehalten.[8]
Eine 2004 mit 40 deutschen Patienten, überwiegend aus ländlichen Umgebungen Süddeutschlands, durchgeführte Fall-Kontroll-Studie stützte diese Feststellungen. Landwirte unterliegen in den süddeutschen Endemiegebieten im Vergleich zu Angehörigen anderer Berufe einem höheren Erkrankungsrisiko. Die Heuernte, insbesondere in der Nähe von Gewässern, birgt dabei ein besonders hohes Risiko. Der Besitz eines eigenen Gartens steigert die Wahrscheinlichkeit einer Erkrankung nur beim Anbau von Gemüse. Der Verzehr von ungewaschenem Obst einschließlich Beeren, Gemüse oder Pilzen konnte, mit Ausnahme des Verzehrs ungewaschener Erdbeeren und dem Kauen von Gras, nicht mit einem erhöhten Risiko in Verbindung gebracht werden. Von möglichen Aktivitäten im Wald konnte nur dem Sammeln von Holz eine erhöhte Infektionsgefahr zugeordnet werden.[11]
Auch die Haltung von Hunden und, in geringerem Maß, von Katzen erhöhte die Wahrscheinlichkeit einer Erkrankung. Für Hundehalter waren die Haltung wildernder Hunde, der unbeaufsichtigte Auslauf im Garten oder die Entwurmung in unregelmäßigen Abständen unter Patienten häufiger als in der Kontrollgruppe. Auch die Haltung freilaufender oder Mäuse jagender Hauskatzen war unter Patienten häufiger. Es wurde berechnet, dass eine Tätigkeit in der Landwirtschaft für zwei Drittel, der Verzehr von ungewaschenem Obst und Gemüse jedoch nur für 25 Prozent der untersuchten Fälle die wahrscheinliche Ursache war.[11]
Erst seit dem Ende des 20. Jahrhunderts wurden Studien zu den Risikofaktoren für eine Erkrankung durchgeführt. Diese stehen in ihren Ergebnissen teilweise im Widerspruch zueinander. So wurde in Österreich für Jäger und Halter von Hauskatzen ein erhöhtes Erkrankungsrisiko ermittelt, nicht jedoch für Landwirte und Hundehalter. In Alaska wurden das Bewohnen von Häusern in der Tundra und die Hundehaltung, insbesondere die Haltung im Freien angebundener Hunde, mit einer höheren Erkrankungsrate in Verbindung gebracht. Der Verzehr von rohem Gemüse, Beeren und Pilzen konnte weder in Österreich noch in Alaska mit Erkrankungen in Verbindung gebracht werden. In Japan wurden die Schweine- und Rinderzucht und das Trinken von Quellwasser als Risikofaktor identifiziert, während die deutsche Studie keinen Zusammenhang zwischen Erkrankungen und dem Trinken von Wasser aus natürlichen Quellen aufzeigte.[11] Eine Studie chinesischer Fälle ergab, dass das Erkrankungsrisiko mit einer größeren Zahl in der Vergangenheit gehaltener Hunde und mit dem Ausmaß des Kontakts zu den Tieren zunahm, weitere Risikofaktoren waren hier die Arbeit in der Landwirtschaft, die Trinkwasserversorgung und die Fuchsjagd.[7]
Klinisches Bild
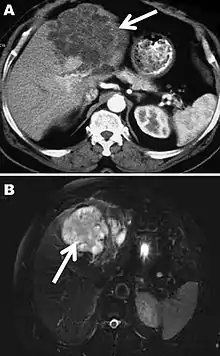
A) Computertomographie,
B) Magnetresonanztomographie
Inkubationszeit
Die Inkubationszeit der alveolären Echinokokkose beträgt fünf bis 15 Jahre bis zum Auftreten klinischer Symptome. Eine Frühdiagnose ist mithilfe serologischer Verfahren möglich.[1]
Verlauf
Nach der Aufnahme von Oncosphären („Eiern“) passieren diese den Magen und durchdringen die Wand des Dünndarms. Über die Pfortader gelangen sie innerhalb von drei bis vier Stunden in die Leber, seltener in Milz, Galle, Lunge oder Gehirn. Dort setzen sie sich fest, wachsen zu einer primären Zyste heran und beginnen, sich durch Knospung auszubreiten. Auf der Oberfläche der vergleichsweise kleinen primären Zyste bilden sich etwa haselnussgroße Tochterzysten, die Finnen von Echinococcus multilocularis, die das befallene Organ infiltrieren. Über das Blut (hämatogen) und das Lymphsystem (lymphogen) kann sich die Infektion metastasierend auf andere Organe ausbreiten.[1] Das Krankheitsbild entspricht dem eines bösartigen (malignen) Tumors und führt unbehandelt nach schleichendem Verlauf innerhalb von zehn Jahren in über 90 % der Fälle zum Tod.[10]
Das optische Erscheinungsbild der Krankheitsherde ist eine Ansammlung kleiner Blasen, die mit nekrotisiertem Gewebe und einer geleeartigen Substanz gefüllt sind. Man spricht hier von einer alveolären (bläschenartigen) Echinokokkose, zur Unterscheidung von der zystischen Echinokokkose bei einer Infektion durch den Hundebandwurm, bei der die Knospung der primären Zyste nach innen erfolgt und die Neubildung insgesamt den Eindruck einer einzigen großen Blase vermittelt.[1]
Symptome
Zu Beginn der Infektion treten kaum Symptome auf, die den Verdacht auf diese Krankheit lenken würden. Selbst nach vielen Jahren treten zunächst nur unspezifische Anzeichen auf, Abgeschlagenheit, Bauchbeschwerden und Gelbsucht. In diesem Krankheitsstadium hat das Larvengewebe im Körper meist schon eine beträchtliche Größe erreicht.
Bei Befall der Leber treten ähnliche Symptome wie bei einem Leberkarzinom oder einer Leberzirrhose auf. Eine Unterscheidung kann durch einen Antikörpernachweis im Blut getroffen werden.[10]
Komplikationen
Die möglichen Komplikationen sind vielfältige Folgeerscheinungen der Zerstörung von Lebergewebe, des raumfordernden Wachstums und der Ausbreitung im Körper des Patienten. Bekannt geworden sind Entzündungen der Gallengänge (Cholangitis), Gelbsucht durch gestörten Gallenabfluss aus der Leber (Obstruktionsikterus), Gallensteine (Cholelithiasis), Sepsis, Pfortaderhochdruck (Portale Hypertension, mit den möglichen weiteren Folgen von Ösophagusvarizen, Pfortaderthrombosen und chronischem Budd-Chiari-Syndrom), Thrombosen der unteren Hohlvene (Vena cava inferior), Amyloidose (eine Störung des Proteinhaushalts), Glomerulonephritis (Entzündung der Nierenkörperchen), Metastasen, chronische und akute Leberinsuffizienz (Leberversagen) und Gallenfistel (Fistula bronchobiliaris).[1] Durch die Knospung des Parasiten in die Blutbahn gelangte Zysten können unmittelbar oder durch das Wachstum an einem ungünstigen Ort wie Lunge oder Herz eine Embolie verursachen.[12]
Diagnose
Die Früherkennung der Infektion ist mit serologischen Untersuchungen (IFT und PHA) realisierbar, bevor irgendwelche Symptome auftreten. Mittels ELISA gelingt in der Regel die serologische Unterscheidung von E. granulosus und E. multilocularis. Kreuzreaktionen mit anderen Bandwürmern sind möglich.
Weiterhin werden sowohl für die Diagnose als auch die Verlaufsbeurteilung einer alveolären Echinokokkose bildgebende Verfahren wie die Ultraschalluntersuchung, die Computertomographie und die Magnetresonanztomographie angewendet. Mit diesen Methoden ist allerdings nur eine Verlaufsbeobachtung der Krankheit erheblich zeitversetzt durch aufeinanderfolgende Untersuchungen zur Beurteilung der Größenveränderung parasitärer Schädigungen möglich. Leberschäden sind hingegen durch unterschiedliche Aktivität einzelner Bereiche charakterisiert, die etwa mit Hilfe von [18F]-Fluoro-Desoxyglukose-Positronen-Emissions-Tomographie (FDG-PET) bestimmt werden kann.[13]
Bei Befall der Leber gilt es andere raumfordernde Rundherde wie vor allem bei einem Amöbenabszess (durch Amöben verursachtes Eitergeschwür) auszuschließen.
Therapie
Eine frühzeitige Diagnose und eine frühe, konsequent durchgeführte Therapie können zu einer vollständigen Heilung führen.
Therapiemöglichkeiten schließen Chemotherapie, Operation und palliative Maßnahmen ein; meist ist eine langjährige Behandlung mit Benzimidazol-Derivaten unerlässlich. Dafür sind zurzeit Albendazol und Mebendazol in Deutschland amtlich zugelassen. Diese medikamentöse Therapie ist bislang meist zeitlebens erforderlich, da nach derzeitigem Wissensstand die oben genannten Substanzen in der überwiegenden Mehrzahl der Fälle nur parasitostatische Wirkung haben, d. h. sie hemmen nur das Wachstum der Parasiten, führen aber nicht ihr Absterben herbei. Die genannten Medikamente können schwerwiegende Nebenwirkungen haben, weshalb die Benzimidazol-Therapie in etwa zehn Prozent der Fälle abgebrochen wird. Da es in etwa 16 Prozent der Fälle auch noch zu einem Therapieversagen kommt, sind neue therapeutische Ansätze dringend gefragt.
Da bei der alveolären Echinokokkose der Parasitenbefall sehr oft erst Jahre nach der Infektion festgestellt wird, besteht bei vielen Patienten bereits bei Erstdiagnose Inoperabilität. Hier kann nur eine langjährige Behandlung die fortschreitende Verschlimmerung der Erkrankung und weitreichende Organschäden verhindern.
Mit FDG-PET wird eine verbesserte Verlaufskontrolle möglich, da die parasitäre Aktivität jederzeit bestimmt werden kann. Dies ermöglicht es, bei ca. 25 % der Patienten die Benzimidazol-Therapie zeitweilig oder dauerhaft zu unterbrechen.
Vorbeugung
Die Seltenheit der Erkrankung und ihre lange Inkubationszeit erschweren individuelle und öffentliche Maßnahmen der Vorbeugung. Persönliche Hygiene ist für Menschen mit einem erhöhten Risiko der Erkrankung, wie Berufstätigen in der Landwirtschaft und Hundehalter, die einzige zu empfehlende Vorsorgemaßnahme, einen Impfschutz gibt es nicht. Auf der Ebene des staatlichen Gesundheitsschutzes werden in den Endemiegebieten Maßnahmen zum Zurückdrängen des Fuchsbandwurms ergriffen, in nicht betroffenen Regionen und Staaten wird versucht ein Einwandern des Erregers zu verhindern.
Individuelle Vorbeugung
Beim Umgang mit mäusefangenden Haustieren wie Hunden oder Katzen ist Hygiene der beste Infektionsschutz für den Menschen. Nach der Berührung des Fells mit den Händen, zum Beispiel durch Streicheln, sollten diese nicht ungewaschen zum Mund geführt werden, insbesondere wenn das Fell in der Afterregion berührt wurde. Hunde und Katzen, die in der Nähe von Fuchs-Populationen gehalten werden, sollten regelmäßig entwurmt werden.[14]
Als Vorbeugung einer Übertragung durch kontaminierte Lebensmittel, sollten diese vor dem Verzehr gründlich gewaschen oder genügend erhitzt werden.[15] In der Landwirtschaft beschäftigten Personen wird das Tragen von Handschuhen beim Umgang mit Erde, Pflanzen und Holz empfohlen. Solange das Einatmen infektiösen Materials nicht als Infektionsweg ausgeschlossen werden kann, kann man durch das Tragen von Staubschutzmasken bei Arbeiten in staubiger Umgebung das mögliche Risiko senken.[11]
Die Weltorganisation für Tiergesundheit (OIE) empfiehlt für den Umgang mit infektiösem Material die Dekontamination durch Hitze, heißes Wasser mit einer Temperatur von mindestens 85 °C wird als sehr effektiv bezeichnet. Für Arbeitsmittel wird ein Einfrieren mit einer Kerntemperatur von −80 °C für 48 Stunden, oder von −70 °C für 4 Tage empfohlen, alternativ ist ein Erhitzen auf 70 °C für 12 Stunden möglich. Eine chemische Desinfizierung ist unzuverlässig.[16]
Meldepflicht
Im Jahr 2001 wurden mit Inkrafttreten des Infektionsschutzgesetzes die Echinokokkosen des Menschen in Deutschland meldepflichtig.[17] Es ist nämlich der direkte oder indirekte Nachweis von Echinococcus sp. (also auch des Fuchsbandwurms) nichtnamentlich meldepflichtig nach § 7 Absatz 3 des Infektionsschutzgesetzes (IfSG). Zur Meldung an das Robert Koch-Institut sind die mikrobiologischen Labore und Pathologen verpflichtet, die durch histopathologische oder serologische Untersuchungen eine Echinokokkose diagnostiziert haben (vgl. § 8, § 10 IfSG). Behandelnde Haus- und Klinikärzte müssen im Fall eines positiven Laborbefundes zusätzliche Informationen zur Bestätigung der Diagnose liefern, wie zum Beispiel Röntgenaufnahmen, sie sind jedoch nicht dazu verpflichtet, unabhängig von den Laboren eine eigene Diagnose zu melden. Dadurch werden dem Robert Koch-Institut und den Gesundheitsbehörden nicht alle Fälle der alveolären Echinokokkose bekannt; in einer statistischen Untersuchung über den Zeitraum von 2003 bis 2005 wurde der Anteil nicht gemeldeter Fälle in Deutschland auf 67 Prozent geschätzt.[18]
In Österreich besteht seit 2004 eine Anzeigepflicht nach dem Epidemiegesetz 1950 und der Verordnung betreffend anzeigepflichtige übertragbare Krankheiten.[19] In Österreich sind nämlich Verdachts-, Erkrankungs- und Todesfälle am Fuchsbandwurm (Echinococcus multilocularis) anzeigepflichtig (gemäß § 1 Abs. 1 Ziffer 1 Epidemiegesetz 1950). Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz 1950).
Darüber hinaus sind „Echinokokkose und ihre Erreger“ nach der EU-Richtlinie zur Überwachung von Zoonosen und Zoonoseerregern vom 17. November 2003 durch die Mitgliedsstaaten der Europäischen Union zu überwachen.[20][17]
In der Schweiz besteht für die humanen Echinokokkosen seit 1997 keine Meldepflicht mehr.[21]
Bekämpfung des Fuchsbandwurms
Es gilt als ausgeschlossen, den Fuchsbandwurm in einem Endemiegebiet vollständig zu beseitigen. Durch eine Entwurmung der Füchse mithilfe präparierter Köder kann jedoch deren Parasitenbelastung und die Zahl der in die Umwelt abgegebenen Wurmeier verringert werden. Der Lebenszyklus des Fuchsbandwurms wird in einer Region auch dann aufrechterhalten, wenn nur ein Prozent der Zwischenwirte infiziert ist. Daher erfordert die Bekämpfung des Fuchsbandwurms eine fortdauernde Behandlung der Hauptwirte.[22] Wo Bekämpfungsmaßnahmen durchgeführt werden, sind sie vor Beginn der kalten Jahreszeit am effektivsten, da bei kühler Witterung ausgeschiedene Wurmeier besonders lange infektiös bleiben und die Infektionsrate der Zwischenwirte stärker ansteigen lassen.[23]
Reisebeschränkungen
Als Reaktion auf die seit einigen Jahrzehnten beobachtete Ausbreitung des Fuchsbandwurms haben mehrere Staaten, die bislang frei vom Fuchsbandwurm sind oder von denen dies vermutet wird, Beschränkungen für die Einfuhr von potenziellen Hauptwirten erlassen. Aus diesem Grund verlangen Großbritannien, Irland, Malta, Schweden und Finnland beim Grenzübertritt mit Heimtieren wie Hunden oder Hauskatzen eine Bescheinigung über eine kürzlich durchgeführte Entwurmung. Diese Regelungen stehen für eine Übergangszeit im Einklang mit dem Recht der Europäischen Union. Staaten, die sich offiziell als frei vom Fuchsbandwurm erklären, können unbefristete Regelungen dieser Art treffen. Davon hat Norwegen, soweit es das Festland angeht, Gebrauch gemacht. Schweden und Finnland streben für sich an, ebenfalls die Freiheit vom Fuchsbandwurm nachzuweisen, um dem Beispiel folgen zu können.[24]
Geschichte
Antike und Mittelalter
Der Befall des Darms von Tieren und Menschen mit Bandwürmern ist seit der Frühzeit bekannt, und pflanzliche Heilmittel zur Linderung der mit einem Wurmbefall einhergehenden Beschwerden kennen viele Naturvölker. Auch die von Echinokokken hervorgerufenen Krankheitsbilder bei ihren Zwischenwirten waren bereits in der Antike bekannt. Der Talmud erwähnt Zysten in den Eingeweiden von Opfertieren, Hippokrates beschrieb im 4. Jahrhundert v. Chr. wassergefüllte Tumore in den Lungen von Rindern, Schafen und Schweinen, und dass sich nach dem Platzen einer wassergefüllten Leber der Bauchraum mit Wasser fülle und der (menschliche) Patient sterbe. Im 2. Jahrhundert n. Chr. interpretierte Galen den Aphorismus Hippokrates’ als Beschreibung der Ruptur einer Hydatidzyste. Es folgten bis in die Neuzeit gelegentliche Berichte über die von zystenbildenden Bandwürmern hervorgerufenen Krankheitsbilder, ohne dass Parasiten als Ursache oder gar der Zusammenhang zwischen den Würmern des Darms und den Zysten erkannt wurden.
Biologie des Erregers
Die Gattung Echinococcus wurde 1801 von Karl Asmund Rudolphi aufgestellt.[25] Die experimentelle Verfütterung von befallenen Zwischenwirten an Hunde und andere Hauptwirte, sowie aus dem Kot von Hunden isolierten Eiern an Schweine führten erst in der Mitte des 19. Jahrhunderts zu der Erkenntnis, dass Bandwürmer einen mehrstufigen Entwicklungszyklus mit einem Wirtswechsel durchlaufen. Den Lebenszyklus des Hundebandwurms (Echinococcus granulosus) mit dem Schaf als Zwischenwirt beschrieb Carl von Siebold 1853 und 1854.[26] Die zoologische Erstbeschreibung des Fuchsbandwurms lieferte Rudolf Leuckart 1863, seine Rolle als Erreger der alveolären Echinokokkose blieb aber unerkannt.[27]
Zystische Echinokokkose
Ab dem Ende des 17. Jahrhunderts wurde die tierische Natur einiger der in menschlichem und tierischen Gewebe entdeckten „Blasen“ erkannt, und 1782 beschrieb Johann August Ephraim Goeze die Ähnlichkeit der Scolici der Echinokokken mit den „Köpfchen“ der schon bekannten Bandwürmer. Diese Erkenntnisse erreichten keine weite Verbreitung.[26] Am 17. Februar 1863 punktierte der Berliner Arzt Bernhard Naunyn eine große Leberzyste eines Patienten und infizierte mit der gewonnenen Flüssigkeit erfolgreich einen Hund mit dem Hundebandwurm (Echinococcus granulosus). Daraufhin wurde der Entwicklungszyklus des Hundebandwurms durch Rudolf Leuckart beschrieben, das Entstehen der zystischen Echinokokkose des Menschen war aufgeklärt.[26][28][29]
Beschreibung der alveolären Echinokokkose
1852 und 1854 hatte der Münchner Mediziner Ludwig von Buhl einen von den bis dahin bekannten Geschwulstformen abweichenden Lebertumor beschrieben, der aus zahlreichen kleinen, mit einer gallertartigen Masse gefüllten Blasen bestand. Er bezeichnete die Neubildung als „Alveolarkolloid“ und betrachtete sie als eine Form degenerierten Gewebes, die Ursache der Erkrankungen blieb ihm jedoch verborgen. Ernst Zeller veröffentlichte 1854 in Tübingen seine Dissertation unter dem Titel „Alveolarkolloid der Leber“. Er entdeckte zwar in einigen der Bläschen Echinokokken, doch er zog nicht die richtigen Schlüsse aus seiner Beobachtung. Aus dem gleichen Jahr stammt die Züricher Dissertation „Zwei Rückbildungsformen des Carcinoms“ von Wilhelm Meyer, in der dieser die Erkrankung als „Gallertkrebs“ bezeichnet. Erst der Würzburger Arzt Rudolf Virchow erkannte den neuen „Alveolarkolloid“ oder „Gallertkrebs“ 1855 nach intensiven mikroskopischen Untersuchungen als parasitäre Erscheinung. Dabei wurde er wie Zeller durch den Zufall begünstigt, dass in dem untersuchten Gewebe, anders als in den meisten Fällen, Protoscolices zu sehen waren. Virchow zog die richtigen Schlüsse aus seiner Beobachtung und erkannte die Ursache der Neubildung. In Anlehnung an den schon lange als Wurmerkrankung bekannten (unilokulären) „Echinococcus“ nannte er die Erkrankung „multilokuläre ulzerierende Echinokokkengeschwulst der Leber“ und veröffentlichte einen detaillierten Bericht über die Symptome, den Verlauf und die pathologischen Befunde der Erkrankung.[26][28][30]
Ludwig von Buhl gratulierte Virchow in einem Schreiben und erwähnte dabei, dass Carl von Siebold ihm ein Muster eines gleichartigen Tumors aus einer Tierleber zugeschickt hatte. Diese Mitteilung brachte Virchow dazu, den zoonotischen Charakter der Echinokokkosen als Erster zu erkennen. Einzig an der Artbestimmung des Erregers scheiterte er, er hielt ihn für einen Hundebandwurm.[30] 1875 vertrat Fritz Morin in seiner Doktorarbeit die Ansicht, dass die beiden Krankheiten durch verschiedene Erreger verursacht würden, er konnte sich jedoch nicht mit seiner Auffassung durchsetzen.[28] Die neue Krankheit galt, auch vor dem Hintergrund des Urteils, das der allgemein anerkannte und geschätzte Virchow abgegeben hatte, lediglich als eine Laune der Natur, als eine entartete Form der Infektion mit dem Hundebandwurm.[26][27]
Identifizierung des Erregers
Bis in die 1950er Jahre galt als sicher, dass die alveoläre und die zystische Echinokokkose vom Hundebandwurm hervorgerufen werden, der aus unbekannten Gründen verschiedene Krankheitsbilder hervorrufen könne. Erst 1955 stand nach Untersuchungen durch Robert L. Rausch und Everett L. Schiller in Alaska und Hans Vogel in Deutschland der Fuchsbandwurm als Erreger der alveolären Echinokokkose fest.[26][31]
Trivia
Während des Strafverfahrens gegen den ehemaligen Vorsitzenden des Staatsrats der DDR, Erich Honecker, wurde die Verhandlungsfähigkeit des Angeklagten von seinen Verteidigern in Frage gestellt und eine Einstellung des Verfahrens gefordert. Der Angeklagte habe einen bösartigen Tumor im rechten Leberlappen und werde das Ende des Verfahrens aller Voraussicht nach nicht erleben, es sei inhuman, gegen einen Sterbenden zu verhandeln. Tatsächlich wurde bei einer Computertomographie in der Berliner Charité ein raumfordernder Prozess von etwa fünf Zentimetern Größe im rechten Leberlappen festgestellt. Beraten durch den Mediziner Julius Hackethal machte der Berliner Rechtsanwalt Hanns-Ekkehard Plöger als Vertreter einer Nebenklägerin, der Mutter des 1986 an der Berliner Mauer erschossenen Michael Bittner, geltend, Honecker leide nicht an Leberkrebs, sondern „nur“ an einem Fuchsbandwurm.[32][33]
Weblinks
- Robert Koch-Institut, Veröffentlichungen des Robert Koch-Instituts zu Echinokokkosen
- Bundesinstitut für Risikobewertung, Veröffentlichungen des Bundesinstituts für Risikobewertung zu Echinokokkosen
- Spiegel Online, „Unheimlicher Parasit: Forscher sagen Fuchsbandwurm den Kampf an“, Artikel vom 7. August 2009, abgerufen am 20. Dezember 2013
Einzelnachweise
- Erwin Kuntz und Hans-Dieter Kuntz: Parasitic infections and the liver. In: Erwin Kuntz und Hans-Dieter Kuntz: Hepatology. Principles and Practice. 2nd Edition. History, Morphology, Biochemistry, Diagnostics, Clinic, Therapy. Springer Verlag, Berlin, Heidelberg 2006, ISBN 978-3-540-28976-0, S. 485–504.
- Erwin Kuntz und Hans-Dieter Kuntz: Parasitic infections and the liver. In: Erwin Kuntz und Hans-Dieter Kuntz: Hepatology. Principles and Practice. 2nd Edition. History, Morphology, Biochemistry, Diagnostics, Clinic, Therapy. Springer Verlag, Berlin, Heidelberg 2006, ISBN 978-3-540-28976-0, S. 485–504, hier S. 497.
- Dennis Tappe, August Stich und Matthias Frosch: Emergence of Polycystic Neotropical Echinococcosiss. In: Emerging Infectious Diseases, Band 14, Nr. 2, 2008, S. 292–297, PMC 2600197 (freier Volltext).
- Artikel Echinococcus. In: Heinz Mehlhorn: Encyclopedic Reference of Parasitology. Biology, Structure, Function. Springer Verlag, Berlin, Heidelberg, New York 2001, ISBN 3-540-66239-1, S. 410.
- J. Eckert u. a. (Hrsg.): WHO/OIE Manual on Echinococcosis in Humans and Animals: a Public Health Problem of Global Concern. Office International des Epizooties (OIE), Paris 2002, ISBN 92-9044-522-X. (PDF, 5,6 MB, abgerufen am 17. Dezember 2013)
- Tamás Sréter u. a.: Echinococcus multilocularis: An Emerging Pathogen in Hungary and Central Eastern Europe? In: Emerging Infectious Diseases. Band 9, Nr. 3, 2003, S. 384–386, PMC 2958538 (freier Volltext).
- Li Tiaoying u. a.: Echinococcosis in Tibetan Populations, Western Sichuan Province, China. In: Emerging Infectious Diseases. Band 11, Nr. 12, 2005, S. 1866–1873, PMC 3367622 (freier Volltext).
- Petra Kern u. a.: European Echinococcosis Registry: Human Alveolar Echinococcosis, Europe, 1982–2000. In: Emerging Infectious Diseases. Band 9, Nr. 3, 2003, S. 343–349, PMC 2958541 (freier Volltext).
- Alexander Schweiger et al.: Human Alveolar Echinococcosis after Fox Population Increase, Switzerland. In: Emerging Infectious Diseases, Band 13, Nr. 6, 2007, S. 878–882, PMC 2792858 (freier Volltext).
- Informationen des Veterinär- und Lebensmittelüberwachungsamtes - Echinokokkose – Fuchsbandwurm, Rathauskurier Stadt Weimar Nr. 3/21, Seite 33, 13. März 2021
- Petra Kern u. a.: Risk Factors for Alveolar Echinococcosis in Humans. In: Emerging Infectious Diseases. Band 10, Nr. 12, 2004, S. 2088–2093, PMC 3323393 (freier Volltext).
- Ursus-Nikolaus Riede und Martin Werner: Color Atlas of Pathology. Thieme, Stuttgart, New York 2004, ISBN 3-13-127781-5
- S. Reuter u. a.: Pericystic Metabolic Activity in Alveolar Echinococcosis: Assessment and Follow-Up by Positron Emission Tomography. In: Clinical Infectious Diseases. Vol. 29, Iss. 5, 1999, S. 1157–1163, doi:10.1086/313438, online
- wissenschaft.de: Heidelbeeren, Bärlauch und Hund: Wo der Fuchsbandwurm wirklich lauert. In: wissenschaft.de. 30. Mai 2007, abgerufen am 8. September 2019.
- Bundesamt für Lebensmittelsicherheit und Veterinärwesen: Parasitäre Erreger in Lebensmitteln und Trinkwasser. In: admin.ch, abgerufen am 12. Februar 2020.
- Office International des Epizooties (Hrsg.): Manual of Diagnostic Tests and Vaccines for Terrestrial Animals (Mammals, Birds and Bees). Sixth Edition, Volume 1, S. 175–189, Office International des Epizooties (OIE), Paris 2008, ISBN 978-92-9044-718-4 Online PDF (Memento vom 17. Dezember 2013 im Internet Archive) 11,2 MB, abgerufen am 16. Dezember 2013.
- K. Alpers u. a.: Zoonotische Infektionen beim Menschen. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. Band 47, Nummer 7, Juli 2004, S. 622–632, ISSN 1437-1588, doi:10.1007/s00103-004-0867-7, Online (PDF, 340 kB) (Memento vom 18. Dezember 2013 im Internet Archive)
- Pernille Jorgensen u. a.: Underreporting of Human Alveolar Echinococcosis, Germany. In: Emerging Infectious Diseases. Band 14, Nr. 6, 2008, S. 935–937, PMC 2600310 (freier Volltext).
- Institut für Hygiene und Mikrobiologie am Landesklinikum St. Pölten: Meldepflichtige übertragbare Krankheiten in Österreich. In: Hygiene Monitor. Jahrgang 12, Nr. 6+7, 2006, S. 2 (PDF, 2.350 kB) (Memento vom 23. November 2006 im Internet Archive)
- Richtlinie 2003/99/EG des Europäischen Parlaments und des Rates vom 17. November 2003 zur Überwachung von Zoonosen und Zoonoseerregern und zur Änderung der Entscheidung 90/424/EWG des Rates sowie zur Aufhebung der Richtlinie 92/117/EWG des Rates. In: Amtsblatt Nr. L 325 vom 12/12/2003 S. 0031 - 0040. Abgerufen am 25. April 2021.
- Peter Deplazes, Daniel Hegglin: Fuchsbandwurm: In der Schweiz erkranken deutlich mehr Menschen an Alveolärer Echinococcose. In: BVET-Magazin. Heft 3/2007, S. 2–4 PDF (Memento vom 17. Dezember 2013 im Internet Archive) (210 kB, abgerufen am 17. Dezember 2013)
- K. Takumi, J. van der Giessen: Transmission dynamics of Echinococcus multilocularis; its reproduction number, persistence in an area of low rodent prevalence, and effectiveness of control. In: Parasitology. Band 131, Nr. 1, Juli 2005, S. 133–140, ISSN 0031-1820. PMID 16038404.
- Pierre Burlet, Peter Deplazes, Daniel Hegglin: Age, season and spatio-temporal factors affecting the prevalence of Echinococcus multilocularis and Taenia taeniaeformis in Arvicola terrestris. In: Parasites & Vectors. 2011, Artikel 4:6, doi:10.1186/1756-3305-4-6. PMC 3033848 (freier Volltext).
- Helene Wahlström u. a.: Combining information from surveys of several species to estimate the probability of freedom from Echinococcus multilocularis in Sweden, Finland and mainland Norway. In: Acta Veterinaria Scandinavica. 2011, 53(9), doi:10.1186/1751-0147-53-9, PMC 3049754 (freier Volltext).
- Karl Asmund Rudolphi: Beobachtungen über die Eingeweidewürmer. In: Archiv für Zoologie und Zootomie, Band 2, 1801, S. 1–65, Online PDF 3,0 MB, abgerufen am 24. Dezember 2013.
- David I. Grove: A History of Human Helminthology. C.A.B. International, Wallingford (UK) 1990, ISBN 0-85198-689-7, S. 319–353.
- Rudolf Leuckart: Allgemeine Naturgeschichte der Parasiten. Mit besonderer Berücksichtigung der bei dem Menschen schmarotzenden Arten. C. F. Winter’sche Verlagshandlung, Leipzig und Heidelberg 1879, S. 94–117 Online, abgerufen am 24. Dezember 2013.
- Dennis Tappe und Matthias Frosch: Rudolf Virchow and the Recognition of Alveolar Echinococcosis, 1850. In: Emerging Infectious Diseases, Band 13, Nr. 5, 2007, S. 732–735, PMC 2738454 (freier Volltext).
- Rudolf Leuckart: Die menschlichen Parasiten und die von ihnen herrührenden Krankheiten., 2 Bände, C. F. Winter’sche Verlagshandlung, Leipzig und Heidelberg 1863, Band 1, S. 328–389 Online, Digitalisat von Band 1 in der Bayerischen Staatsbibliothek, abgerufen am 25. Dezember 2013.
- Rudolf Virchow: Die multiloculäre, ulcerirende Echinokokkengeschwulst der Leber. In: Verhandlungen der Physikalisch-Medicinischen Gesellschaft zu Würzburg, Band 6, 1855, S. 84–95, ISSN 0931-6507 Online PDF 785 kB, abgerufen am 21. Dezember 2013.
- Herbert Auer, Horst Aspöck: Die zystische und die alveoläre Echinokokkose – Die gefährlichsten Helminthosen Mitteleuropas. In: Denisia. Band 6 (= Kataloge des Oberösterreichischen Landesmuseums. Neue Folge Nr. 184). Linz 2002, ISSN 1608-8700, S. 333–353 (zobodat.at [PDF; 2,7 MB]).
- Rainer Frenkel: Wenn der Tod das Leben überlappt. In: Die Zeit, Nr. 2, 8. Januar 1993, S. 5 Online, abgerufen am 25. Dezember 2013
- Uwe Wesel: Der Honecker-Prozeß. Über den Rechtsstaat, seine Peinlichkeiten und seine Schwierigkeiten. In: Kritische Justiz, 1993, Heft 2, S. 198–206 Online PDF 850 kB, abgerufen am 25. Dezember 2013.