Fuchsbandwurm
Der Fuchsbandwurm (Echinococcus multilocularis) ist eine Art der Bandwürmer (Cestoda) und parasitiert vor allem im Rotfuchs und anderen Arten der Gattung Vulpes. Als Zwischenwirt dienen kleine Säugetiere, vor allem Wühlmäuse und andere Nagetiere. Der Fuchsbandwurm ist der Auslöser der alveolären (bläschenartigen) Echinokokkose, einer lebensgefährlichen Wurmerkrankung des Menschen.
| Fuchsbandwurm | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
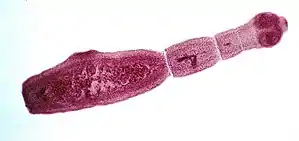
Ausgewachsener Fuchsbandwurm, links die stark vergrößerte Proglottis | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Echinococcus multilocularis | ||||||||||||
| (Leuckart, 1863) Vogel, 1955 |
Merkmale
Wie alle Arten der Gattung Echinococcus ist auch der Fuchsbandwurm ein sehr kleiner Vertreter der Bandwürmer, von denen einzelne Arten mehrere Meter lang werden können. Er erreicht eine Länge von nur rund 1,4 bis 3,4 Millimetern[1] (nach anderen Quellen 1,2 bis 4,5 Millimeter[2]) und ist damit etwas kürzer als der Dreigliedrige Hundebandwurm (E. granulosus), der eine Länge von 2,5 bis 6 Millimetern[1] (nach anderen Quellen 2,0 bis 11,0 Millimeter[2]) erreicht. Der Kopf (Scolex) besitzt vier Saugnäpfe[3] und wie bei vielen Bandwürmern Haken, um sich an der Darmwand des Wirtes festzusetzen. Diese sind in zwei den Scolex umlaufenden Ringen, dem Rostellum, zu je 13 bis 18 Häkchen von 20 bis 34 Mikrometern Länge angeordnet, wobei die äußeren Häkchen geringfügig länger als die inneren sind.
Sein Körper ist in zwei bis sechs,[2] meist vier oder fünf, segmentähnliche Körperabschnitte (Proglottiden) unterteilt, wobei die letzte Proglottis stark vergrößert ist und fast die Hälfte der gesamten Länge des Wurmes ausmacht. In den Proglottiden liegt jeweils ein Satz von Geschlechtsorganen vor, in denen Spermien und später Eier produziert werden. Im vorderen bis mittleren Bereich der Proglottiden liegt die Geschlechtsöffnung (Genitalporus).[4]
Verbreitung

Die Verbreitung des Fuchsbandwurms ist an das Vorhandensein geeigneter Haupt- und Zwischenwirte gebunden. Der Fuchsbandwurm hat ein Verbreitungsgebiet über die gemäßigten bis kalt-gemäßigten Klimazonen der Nordhalbkugel. Ab den 1980er Jahren kam es aber in Deutschland zu einer zunehmenden Verbreitung bis nach Niedersachsen und Brandenburg, verlässliche Zahlen sind aber durch die Unterschiede im Überwachungssystem und im Meldeverhalten der einzelnen Bundesländer kaum vorhanden.[5] In Europa liegt ein Verbreitungsschwerpunkt in Mitteleuropa, vor allem in der Schweiz (Schwerpunkt Kanton Thurgau) und in Deutschland im Bereich der Schwäbischen Alb häufen sich die Vorkommen. In Asien erstreckt sich die Ausbreitung von Russland und weiten Teilen Zentralasiens über China bis nach Japan, Teile der Türkei, des Iran und Indiens scheinen hier den südlichen Rand des Verbreitungsgebiets zu markieren. In Nordamerika reichen die Vorkommen von Alaska und Kanada südwärts bis zu den Bundesstaaten Nebraska, Iowa, Illinois, Indiana und Ohio.[6] In Europa sind lediglich das Vereinigte Königreich, Irland, Finnland und Malta frei von diesem Parasiten.[5]
In Mitteleuropa kommt es so gut wie gar nicht zu einer Überlappung mit dem Verbreitungsgebiet für den Hundebandwurm (Echinococcus granulosus). Ein Grund für diese Verteilung ist noch nicht bekannt. In anderen Regionen, namentlich der Türkei, im Iran, Zentralasien, Sibirien und China,[7] treten beide Arten nebeneinander auf.[4]
Innerhalb des Verbreitungsgebiets hängen Vorkommen und Häufigkeit des Fuchsbandwurms von einer Reihe von Faktoren ab, unter anderem von der individuellen Empfänglichkeit der verfügbaren Wirte, ihrer jeweiligen Populationsdichte und ihrem Nahrungsspektrum. Das führt zu einer inselartigen Verteilung der Populationen innerhalb des Verbreitungsgebiets. Das Auftreten des Fuchsbandwurms und die Prävalenz von Echinokokkosen können sowohl zwischen großen Regionen als auch zwischen nahe beieinanderliegenden Gebieten von nur wenigen Hektar Größe stark schwanken.[6]
Ein Beispiel für derartige schwankende Häufigkeiten stammt aus der Humanmedizin. Die höchste jemals festgestellte Rate an alveolärer Echinokokkose wurde zwischen 2000 und 2002 bei einer Reihenuntersuchung mit 3200 Teilnehmern in einem Kreis der chinesischen Provinz Sichuan ermittelt. Die Prävalenz lag bei 6,2 Prozent; von Dorf zu Dorf schwankte sie zwischen 0 und 14,3 Prozent. Begünstigende Faktoren waren Analphabetismus, Nutztier- und Hundehaltung sowie die örtliche Häufigkeit von Kleinsäugern (potentielle Zwischenwirte des Fuchsbandwurms). In Mitteleuropa erkranken weniger als 5 von 10.000 Menschen an der alveolären Echinokokkose.[7]
Populationsdichte
In manchen Regionen sind bis zu 72 % der Füchse befallen (Südwestdeutschland), in anderen nur bis zu 5 %. Bei einer Untersuchung der städtischen Fuchspopulation in Stuttgart wurde eine Befallsrate von 20 Prozent ermittelt, in Zürich waren es 48 Prozent.[8] Für Oberbayern werden 27 % angegeben.[9] Bei Haushunden und -katzen wurde in einer deutschlandweiten Untersuchung eine Fuchsbandwurm-Befallsrate von 0,3 und 0,35 Prozent festgestellt.[10]
Die Befallsrate der Zwischenwirte nimmt mit ihrem Alter zu und scheint mit der Witterung zu schwanken, wobei Kälte ein Ansteigen bewirkt, die Menge der Niederschläge jedoch eine geringere Rolle spielt. In Zürich und im benachbarten Rifferswil wurden im Jahr 2007 und 2008 Schermäuse (Arvicola terrestris) auf den Befall mit Fuchsbandwürmern untersucht. Dabei betrug die Prävalenz eines Befalls mit Larven des Fuchsbandwurms über die gesamte Studie etwa 15 Prozent, in einem Untersuchungsgebiet schwankte sie jedoch zwischen etwa 40 und fast 80 Prozent.[11]
Ausbreitung
Der Fuchsbandwurm breitet sich seit dem Ende des 20. Jahrhunderts in Europa jenseits der ursprünglichen Verbreitungsgebiete aus. Noch Ende der 1980er Jahre waren in Mitteleuropa nur aus Deutschland, Österreich, der Schweiz und Frankreich Enzootiegebiete bekannt, seither hat sowohl die Infektionsrate der Füchse als auch die Zahl der Vorkommen in diesen Ländern stark zugenommen. Erstfunde und Nachweise für neu entstandene Enzootiegebiete gibt es aus den Niederlanden, Belgien, Luxemburg, Polen, Tschechien, der Slowakei (1999)[12], Italien, Spitzbergen (1999)[13], Dänemark (2000)[14] und Ungarn (2002).[15] Vergleichbare Entwicklungen gab es in Nordamerika, wo sich der Fuchsbandwurm vom Norden Kanadas bis in einige zentrale US-Bundesstaaten ausbreitete, und aus Japan, wo sich eine kleine Population auf die ganze Insel Hokkaidō ausdehnte.[15]
Als eine Ursache der Ausbreitung des Fuchsbandwurms und seiner vielfach zunehmenden Populationsdichte wird angesehen, dass die Bestände des Rotfuchses wegen des Erfolgs der Impfprogramme gegen die Tollwut und der geringeren Bejagung seit den 1980er Jahren in Mitteleuropa stark zugenommen haben, in Mitteleuropa zwischen 1980 und 1995 auf das Vierfache. Für die Ausbreitung in Osteuropa wird neben der Einführung von Tollwut-Impfprogrammen die Umstrukturierung der landwirtschaftlichen Produktion und der Preisverfall für Fuchspelze als möglicher Grund angeführt.[15][16]
Eine Folge des erhöhten Populationsdrucks auf die Füchse besteht darin, dass sie vermehrt städtische Räume besiedeln und den Fuchsbandwurm näher an den Menschen bringen. So stieg die Zahl der im Stadtgebiet von Zürich tot aufgefundenen oder erlegten Füchse seit 1985 auf das Zwanzigfache. Ein Abgleich seit den 1950er Jahren ermittelter schweizerischer Fallzahlen der alveolären Echinokokkose mit den nationalen Jagdstatistiken zeigte, dass Schwankungen der Zahlen erlegter Füchse mit 10 bis 15 Jahren zeitlichen Verzugs, entsprechend der angenommenen Inkubationszeit, Zu- oder Abnahmen der Erkrankungen folgten. In den USA, wo der Kojote (Canis latrans) ein wichtiger Hauptwirt des Fuchsbandwurms ist, wird dessen Einwandern in die Vorstädte mit Sorge betrachtet.[17]
Einen Sonderfall stellt die Einschleppung des Fuchsbandwurms nach Spitzbergen dar. Auf der Insel ist der Polarfuchs der einzige Hauptwirt, ein Kleinsäuger als Zwischenwirt war ursprünglich nicht vorhanden. Die ersten Beobachtungen von Mäusen erfolgten in den 1970er Jahren nahe den Siedlungen russischer Bergleute, es wird vermutet, dass sie mit eingeführtem Tierfutter auf die Insel gelangten.[14] Die Nager wurden zunächst fälschlich als Feldmäuse betrachtet, erst 1990 wurden sie mittels DNA-Analysen als Osteuropäische Feldmäuse identifiziert. Deren ursprüngliches Verbreitungsgebiet erstreckt sich vom Balkan über Finnland bis nach Sibirien. Im Sommer 1999 wurde im Rahmen einer biologischen Erforschung der Mäusepopulation auch eine Untersuchung einzelner Tiere auf Parasitenbefall durchgeführt. Dabei und bei einer umfangreicheren Untersuchung im Folgejahr wurde festgestellt, dass der Fuchsbandwurm bei den Mäusen nicht nur häufig auftritt, sondern dass seine Populationsdichte eine der höchsten jemals festgestellten ist. Als einzige mögliche Erklärung für das Auftreten des Fuchsbandwurms wird das Zuwandern infizierter Polarfüchse über das Polareis angesehen. Die von den infizierten Füchsen ausgeschiedenen Bandwurmeier wurden von den durch den Menschen eingeführten Mäusen aufgenommen, wodurch sich der Fuchsbandwurm auf Spitzbergen etablieren konnte.[13]
Bekämpfung
Versuche, durch eine medikamentöse Behandlung der Füchse deren Parasitenbelastung zu reduzieren, waren zunächst erfolgreich, und die Zahl der in die Umwelt abgegebenen Wurmeier konnte verringert werden. Die Belastung der Zwischenwirte mit Wurmlarven blieb jedoch hoch, und der Lebenszyklus des Fuchsbandwurms wird in einer Region auch dann aufrechterhalten, wenn nur ein Prozent der Zwischenwirte infiziert ist. Daher erfordert die Bekämpfung des Fuchsbandwurms eine fortdauernde Behandlung der Endwirte.[16] Wo Bekämpfungsmaßnahmen durchgeführt werden, sind sie vor Beginn der kalten Jahreszeit am effektivsten, da bei kühler Witterung ausgeschiedene Wurmeier besonders lange infektiös bleiben und die Infektionsrate der Zwischenwirte stärker ansteigen lassen.[11]
In mehreren Staaten, die bislang frei vom Fuchsbandwurm sind oder von denen dies vermutet wird, bestehen Beschränkungen für die Einfuhr von Tieren, die potenzielle Träger einer Infektion sind. Aus diesem Grund verlangen Großbritannien, Irland, Malta, Schweden und Finnland beim Grenzübertritt mit Heimtieren wie Hunden oder Hauskatzen eine Bescheinigung über eine kürzlich durchgeführte Entwurmung. Diese Regelungen stehen für eine Übergangszeit im Einklang mit dem Recht der Europäischen Union. Darüber hinaus betrachtet sich Norwegen, soweit es das Festland angeht, offiziell als frei vom Fuchsbandwurm und hat vergleichbare Einreiseregelungen getroffen. Diese norwegischen Beschränkungen gelten für die Einreise aus allen anderen Staaten als Großbritannien, Irland, Malta, Schweden und Finnland und stehen ebenfalls im Einklang mit europäischem Recht. Schweden und Finnland streben für sich an, ebenfalls die Freiheit vom Fuchsbandwurm nachzuweisen und so eine unbefristete Regelung treffen zu können.[18]
Lebensweise
Lebenszyklus
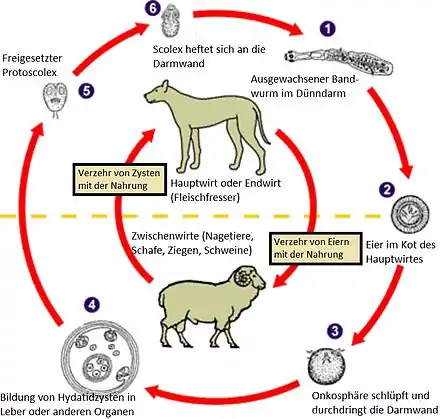
Der Lebenszyklus beginnt mit dem erwachsenen Fuchsbandwurm, der sich im Dünndarm eines Endwirtes niedergelassen hat. In seinem letzten Proglottis reifen die selbstbefruchteten Eier heran, die das erste Larvenstadium des Fuchsbandwurms enthalten. Durch das Abstoßen des letzten Proglottis werden täglich bis zu 200 reife Eier in den Darm des Endwirts abgegeben und gelangen mit dem Kot in die Umwelt. Die Eier sind sehr kältebeständig und können monatelang infektiös bleiben.
Als Zwischenwirt dienen vor allem Wühlmäuse, aber auch alle anderen Säugetiere einschließlich des Menschen können als Fehlzwischenwirt fungieren. Selbst Hunde können bei Aufnahme von Fuchskot gleichzeitig Zwischen- und Endwirt sein.[19] Nach der Aufnahme der Eier durch einen Zwischenwirt löst sich die Eikapsel auf und die so genannte Onkosphäre oder Hexacanthenlarve (6-Haken-Larve) wird frei. Es wird angenommen, dass der niedrige pH-Wert der Umgebung und die Gallenflüssigkeit den Prozess auslösen und dass die Zusammensetzung der Gallenflüssigkeit darüber hinaus bei der Wirtsspezifität des Fuchsbandwurms eine Rolle spielt.
Die Larve durchdringt das Epithelgewebe der Darmwand und gelangt über die Mesenterialvenen und die Pfortader zur Leber des Zwischenwirts, sie kann aber in Ausnahmefällen auch Lunge, Herz oder Milz befallen. Innerhalb des Gewebes setzt sich die Onkosphäre fest und bildet als zweites Larvenstadium die Metazestode oder Finne, die auch als Echinococcus alveolaris[20] bezeichnet wird. Sie ist eine mit gallertartiger Masse gefüllte Blase, die gegen das sie umgebende Organ durch eine Wand aus Bindegewebe abgegrenzt ist. Wie dieser Vorgang ausgelöst und gesteuert wird, ist nicht bekannt.
Aus der Wand der Metazestode entspringen im weiteren Verlauf der Infektion durch Knospung stetig weitere Finnen; es entsteht eine Larvenstruktur, die aus einer Anhäufung blasenartig erscheinender Finnen besteht und das Wirtsgewebe infiltriert. Sie wird daher als Hydatide des alveolären (blasenartigen) Typs von der Hydatide des zystischen Typs des Hundebandwurms abgegrenzt, bei dem durch eine Knospung nach innen eine große Hydatidenblase gebildet wird. Im Rahmen der Knospung können sich Zellverbände oder einzelne Zellen der Metazestode ablösen, über die Blutbahn des Wirts andere Organe erreichen, sich dort festsetzen und weitere Befallsherde bilden.
Nach zwei bis vier Monaten in einem geeigneten Zwischenwirt bilden sich in den Finnen als drittes Larvenstadium die Protoscolices mit eingestülpten Kopfanlagen, und Knospung und Wachstum der Metazestode kommen zum Stillstand.
Beim Menschen als Fehlwirt ist die Knospung der Metazestoden stark verlangsamt und es bilden sich allenfalls wenige Protoscolices. Die Metazestode wächst nach außen, und es kommt in ihrem Zentrum zu Abbauprozessen. So entsteht eine langsam zunehmende Masse aus nekrotisiertem Gewebe, das von einer relativ dünnen Schicht lebenden Parasitengewebes umhüllt ist.
Durch die Erkrankung wird der Zwischenwirt immer schwächer und damit eine leichte Beute für den Endwirt (Hund, Fuchs, Katze). Selbst nach dem natürlichen Tod des Zwischenwirtes bleiben die Metazestoden noch lange infektiös, so dass auch Tiere, die sich von Aas ernähren, zum Endwirt werden können. Nimmt der Endwirt mit der Nahrung Metazestoden auf, so werden sie verdaut und die freigewordenen Protoscolices stülpen ihre Halteorgane aus, mit denen sie sich im Dünndarm des Wirtes festsetzen. Sie wachsen zur neuen Bandwurmgeneration heran, indem sie an dem nun zum Scolex des neuen Bandwurms umgeformten „Kopf“ neue Proglottiden bilden.
Ihre Ernährung im Hauptwirt ist kommensal, die Nahrung wird über ihre Außenhaut, die syncytiale Neodermis, aufgenommen. Sie besteht aus dem „Nahrungsbrei“, der im Dünndarm vorhanden ist und aus dem der Wurm die Nährstoffe resorbiert. Der Stoffwechsel verläuft anaerob über die Glykolyse. Es können tausende Würmer im Endwirt vorkommen, ohne diesen ernsthaft zu beeinträchtigen. Bei starkem Befall verteilen sich die Parasiten gleichmäßig über den gesamten Dünndarm, bei wenigen Parasiten bleibt in der Regel das erste Dünndarmdrittel des Wirtes frei.[3][6]
Wirte

Der Fuchsbandwurm infiziert als Hauptwirte vor allem Angehörige der Gattung Vulpes, in Mitteleuropa, Asien und Nordamerika den Rotfuchs und in den zirkumpolaren Regionen den Polarfuchs. Daneben können Kojote, Wolf und Haushund sowie seltener Wildkatze und Hauskatze befallen werden. Fuchsbandwürmer sind selbst bei starkem Befall des Endwirts für diesen kaum schädlich. Katzen scheinen in der Epidemiologie des Fuchsbandwurms keine Rolle zu spielen, die Anzahl der ausgeschiedenen Eier ist nur gering und ihre Infektiosität ist nicht erwiesen.[19]
Als Zwischenwirt dienen kleine Säugetiere, vor allem Wühlmäuse, die in Deutschland die häufigsten Zwischenwirte sind. Bei ihnen führt eine Infektion mit den Larven des Fuchsbandwurms innerhalb weniger Monate zu einer starken Schwächung oder zum Tod.[10]
Durch die Aufnahme von Eiern des Fuchsbandwurms können auch Hirsche, Elche, Rentiere, Bisons, Haus- und Wildschweine, Pferde, Nutrias und Primaten einschließlich des Menschen infiziert werden. Wenn die in ihnen heranwachsenden Larven des Fuchsbandwurms nicht durch den Verzehr von Fleisch oder Aas des Zwischenwirts auf neue Hauptwirte übergehen, handelt es sich um Fehlzwischenwirte, da der Lebenszyklus des Parasiten mit dem Tod seines Wirts erlischt. Beim Menschen wird durch eine Infektion mit den Eiern des Fuchsbandwurms die Alveoläre Echinokokkose ausgelöst, eine lebensgefährliche Wurmerkrankung. Anders als beim Befall regulärer Zwischenwirte ist der Krankheitsverlauf beim Menschen schleichend, die Inkubationszeit kann bis zu 15 Jahren betragen.[3][4][6]
Systematik
| Verwandtschaftsverhältnisse innerhalb der Gattung Echinococcus | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zwei verschiedene phylogenetische Bäume auf der Basis mitochondrialer DNA (mtDNA) beziehungsweise nukleärer DNA (Kern-DNA). Die Klammerzusätze stehen für verschiedene Genotypen. Nakao et al. 2007[21], Saarma et al. 2009[22] |
Die wissenschaftliche Erstbeschreibung von Echinococcus multilocularis erfolgte durch Rudolf Leuckart im Jahr 1863. Die Systematik der Gattung Echinococcus und damit auch die systematische Position des Fuchsbandwurms ist bislang nicht abschließend geklärt. Problematisch sind dabei vor allem die zahlreichen als Genotypen (in den Kladogrammen als G1, G2 usw. bezeichnet) beschriebenen Formen von Echinococcus granulosus, die in den bisherigen molekularbiologischen Untersuchungen nicht als monophyletische Kladen erkennbar sind. Diese werden in der aktuellen Literatur und daher auch in den nebenstehenden Kladogrammen zum Teil bereits als eigenständige Arten E. equinus, E. ortleppi, E. canadensis und E. intermedius betrachtet.[22][21]
Die bisherigen molekularbiologischen Untersuchungen zur Systematik der Echinococcus-Arten basieren auf mitochondrialer[21] sowie nukleärer[22] DNA (Kern-DNA). Die Ergebnisse dieser beiden Studien unterscheiden sich deutlich: Bei der Nutzung der Kern-DNA stellen der Fuchsbandwurm und der in Tibet endemische E. shiquicus die beiden basalen Arten der Gattung dar und die verschiedenen Genotypen des E. granulosus bilden mit E. felidis ein Taxon.[22] Bei der Verwendung mitochondrialer DNA werden diese beiden Arten dagegen inmitten der E. granulosis-Genotypen platziert.[21]
Saarma et al. 2009 befürworten die Nutzung der Kern-DNA zur Ermittlung der phylogenetischen Verwandtschaftsverhältnisse, da die mitochondriale DNA in diesem Fall der parasitischen Lebensweise durch ihre zufällige Mutationsrate ohne Rekombination die tatsächliche Artentwicklung nicht nachzeichne.[22] Entsprechend dieser Analyse stellt Echinococcus multilocularis die basalste Art der Gattung dar, gefolgt von E. shiquicus.[22]
Nachweisverfahren
Es besteht im Rahmen der öffentlichen Gesundheitsvorsorge ein großes Interesse daran, den Fuchsbandwurm als Erreger einer lebensbedrohlichen Zoonose sicher zu identifizieren und Angaben über seine Verbreitung und Häufigkeit zu machen.
Der Fuchsbandwurm lässt sich im Erwachsenenstadium und als Larve mit Hilfe äußerlicher Merkmale sicher von den übrigen Vertretern der Gattung Echinococcus unterscheiden. Die Eier können jedoch mit denen anderer Arten der Gattungen Echinococcus und Taenia verwechselt werden, eine sichere Identifizierung erfordert eine Genanalyse.
Zur Identifizierung der Larven in Zwischenwirten wird die makroskopische oder mikroskopische Untersuchung oder eine DNA-Analyse herangezogen. Beim Menschen werden zur Diagnose verschiedene serologische Untersuchungen angewendet, die eine Infektion erkennen lassen, bevor Symptome auftreten.
Bei den Hauptwirten ist die Diagnose durch eine Untersuchung des Dünndarms im Rahmen einer Nekropsie möglich, hierbei wird nach erwachsenen Fuchsbandwürmern gesucht. Heute kann der Kot sowohl lebender als auch toter Endwirte mit einem spezifischen ELISA auf Koproantigene und durch DNA-Nachweis mittels PCR untersucht werden. Diese Verfahren eignen sich auch zur Untersuchung von in der Natur vorgefundenen Kotproben und werden zur systematischen Untersuchung der Populationen von Füchsen, Hunden und Katzen sowie in der veterinärmedizinischen Diagnostik verwendet. Ihr Vorteil liegt vor allem in der geringeren Gefährdung des mit der Untersuchung befassten Personals. Die Zuverlässigkeit des ELISA bleibt unter ungünstigen Bedingungen wie einer zusätzlichen Infektion mit dem Hundebandwurm hinter der einer Nekropsie zurück, gegen DNA-Analysen sprechen der hohe technische Aufwand und die Kosten.[4]
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis von Echinococcus sp. (also auch des Fuchsbandwurms) nichtnamentlich meldepflichtig nach § 7 Absatz 3 des Infektionsschutzgesetzes (IfSG). Die Meldepflicht betrifft in erster Linie Labore (vgl. § 8 IfSG).
In Österreich sind Verdachts-, Erkrankungs- und Todesfälle am Fuchsbandwurm (Echinococcus multilocularis) anzeigepflichtig (gemäß § 1 Abs. 1 Ziffer 1 Epidemiegesetz 1950). Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz).
Siehe auch

Weblinks
- Wo der Fuchsbandwurm wirklich lauert (Hintergrundartikel in Wissenschaft.de vom 30. Mai 2007)
- Patienteninfos der Deutschen Internistenverbandes
- Spiegel Online: Unheimlicher Parasit
- Situation in Österreich (PDF; 340 kB)
- Podcast Fuchsbandwurm auf www.forstcast.net
- Universität Würzburg: Fuchsbandwurm
Einzelnachweise
- Artikel Echinococcus in: Heinz Mehlhorn: Encyclopedic Reference of Parasitology. Biology, Structure, Function Springer Verlag, Berlin, Heidelberg, New York 2001. ISBN 3-540-66239-1; S. 410.
- Ning Xiao, Jiamin Qiu, Minoru Nakao, Tiaoying Li, Wen Yang, Xingwang Chen, Peter M. Schantz, Philip S. Craig, Akira Ito: Echinococcus shiquicus n. sp., a taeniid cestode from Tibetan fox and plateau pika in China. International Journal for Parasitology 35 (6), 2005; S. 693–701; doi:10.1016/j.ijpara.2005.01.003. PMID 15862582.
- Christian Konrad: Molecular analysis of insulin signaling mechanisms in Echinococcus multilocularis and their role in the host-parasite interaction in the alveolar echinococcosis, Dissertation, Bayerische Julius-Maximilians-Universität, Würzburg 2007 Online PDF 5,6 MB, abgerufen am 16. Dezember 2013.
- Office International des Epizooties (Hrsg.): Manual of Diagnostic Tests and Vaccines for Terrestrial Animals (Mammals, Birds and Bees). Sixth Edition, Volume 1, S. 175–189, Office International des Epizooties (OIE), Paris 2008, ISBN 978-92-9044-718-4 Online PDF (Memento vom 17. Dezember 2013 im Internet Archive) 11,2 MB, abgerufen am 16. Dezember 2013.
- Pavlo Maksimov et al.: Epidemiologie des „kleinen Fuchsbandwurms“. In: Tierärztliche Umschau Band 75, 2020, Heft 1, S. 12–16.
- Johannes Eckert et al. (Hrsg.): WHO/OIE Manual on Echinococcosis in Humans and Animals: a Public Health Problem of Global Concern, Office International des Epizooties (OIE), Paris 2002, ISBN 92-9044-522-X Online PDF 5,6 MB, abgerufen am 17. Dezember 2013.
- Li Tiaoying et al.: Echinococcosis in Tibetan Populations, Western Sichuan Province, China. In: Emerging Infectious Diseases, Band 11, Nr. 12, 2005, S. 1866–1873, PMC 3367622 (freier Volltext).
- Petra Kern et al.: European Echinococcosis Registry: Human Alveolar Echinococcosis, Europe, 1982–2000. In: Emerging Infectious Diseases, Band 9, Nr. 3, S. 343–349, PMC 2958541 (freier Volltext).
- Fuchsbandwurm
- Barbara Hinney und Anja Joachim: Magen-Darm-Parasiten bei Hund und Katze. (Memento vom 24. März 2019 im Internet Archive) In: Kleintierpraxis 58 (2013), S. 256–278. doi:10.2377/0023-2076-58-256
- Pierre Burlet, Peter Deplazes und Daniel Hegglin: Age, season and spatio-temporal factors affecting the prevalence of Echinococcus multilocularis and Taenia taeniaeformis in Arvicola terrestris. In: Parasites & Vectors. 2011, Artikel 4:6, doi:10.1186/1756-3305-4-6. PMC 3033848 (freier Volltext).
- Valéria Letková et al.: The red fox (Vulpes vulpes L.) as a source of zoonoses. In: Veterinarski Arhiv, Band 76, Supplement, 2006, S. S73–S81, ISSN 0372-5480 Online PDF 400 kB, abgerufen am 18. Dezember 2013.
- Heikki Henttonen et al.: Echinococcus multilocularis on Svalbard: introduction of an intermediate host has enabled the local life-cycle. In: Parasitology, Band 123, Nr. 6, 2001, S. 547–552, ISSN 0031-1820, doi:10.1017/S0031182001008800. PMID 11814041
- Hilde Kruse, Anne-Mette Kirkemo und Kjell Handeland: Wildlife as Source of Zoonotic Infections. In: Emerging Infectious Diseases, Band 10, Nr. 12, 2004, S. 2067–2072, PMC 3323390 (freier Volltext).
- Tamás Sréteret al.: Echinococcus multilocularis: An Emerging Pathogen in Hungary and Central Eastern Europe? In: Emerging Infectious Diseases, Band 9, Nr. 3, S. 384–386, PMC 2958538 (freier Volltext).
- K. Takumi und J. van der Giessen: Transmission dynamics of Echinococcus multilocularis; its reproduction number, persistence in an area of low rodent prevalence, and effectiveness of control. In: Parasitology, Band 131, Nr. 1, Juli 2005, S. 133–140, ISSN 0031-1820. PMID 16038404.
- Alexander Schweiger et al.: Human Alveolar Echinococcosis after Fox Population Increase, Switzerland. In: Emerging Infectious Diseases, Band 13, Nr. 6, 20075, S. 878–882, PMC 2792858 (freier Volltext).
- Helene Wahlström et al.: Combining information from surveys of several species to estimate the probability of freedom from Echinococcus multilocularis in Sweden, Finland and mainland Norway. In: Acta Veterinaria Scandinavica, 2011, 53(9), doi:10.1186/1751-0147-53-9, PMC 3049754 (freier Volltext).
- Katharina Raue und Christina Stube: Echinococcus multilocularis-Infektionen bei Hund und Katze. In: Tierärztliche Umschau Band 75, 2020, Heft 1, S. 6–11.
- Wörterbuch der Veterinärmedizin, 2. Aufl. S. 306
- M. Nakao, D. P. McManus, P. M. Schantz, P. S. Craig, A. Ito: A molecular phylogeny of the genus Echinococcus inferred from complete mitochondrial genomes. Parasitology 134(5): S. 713–722. PMID 17156584.
- U. Saarma, I. Jõgisalu, E. Moks, A. Varcasia, A. Lavikainen, A. Oksanen, S. Simsek, V. Andresiuk, G. Denegri, L.M. González, E. Ferrer, T. Gárate, L. Rinaldi, P. Maravilla: A novel phylogeny for the genus Echinococcus, based on nuclear data, challenges relationships based on mitochondrial evidence. Parasitology 136 (3), 2009: S. 317–328. PMID 19154654.