Trihexyphenidyl
Trihexyphenidyl, auch Benzhexol und Trihex genannt, ist ein Arzneistoff. Er zählt zur Gruppe der Muskarinrezeptor-Antagonisten, ähnlich wie Atropin. Trihexyphenidyl hemmt selektiv die Wirkung von Acetylcholin auf die M1-Muskarin-Rezeptoren[3] im Striatum des Gehirns. Trihexyphenidyl ist ein Anticholinergikum und wird als Antiparkinsonmittel eingesetzt. Es ist seit 1951 unter den Handelsnamen Artane und Parkopan zugelassen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-Trihexyphenidyl_Structural_Formula_V1.svg.png.webp) | ||||||||||||||||||||||
| Stereoisomerengemisch – Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Trihexyphenidyl | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C20H31NO | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N04AA01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 301,5 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Der Arzneistoff besteht aus einem 1:1-Gemisch zweier enantiomeren chemischen Verbindungen aus der Gruppe der Aminoalkohole.
Wirkung
Trihexyphenidyl hat eine entspannende Wirkung auf die glatte Muskulatur. Dies verringert den Tremor bei der Parkinson-Krankheit.
Gewinnung und Darstellung
Trihexyphenidyl kann auf zwei Wegen dargestellt werden.
Im ersten Schritt von Weg 1 wird 2-(1-Piperidino)propiophenon durch Aminomethylierung von Acetophenon mit Piperidin und Paraformaldehyd gewonnen (Mannich-Reaktion). Im zweiten Schritt reagiert dieses mit Cyclohexylmagnesiumbromid in einer Grignard-Reaktion.
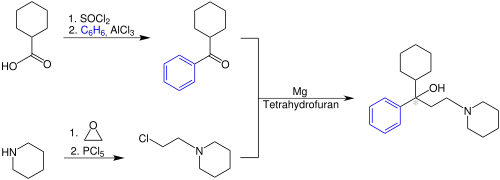
Für die 2. Synthese wird Benzol mit Cyclohexancarbonsäurechlorid im Rahmen einer Friedel-Crafts-Acylierung zum Cyclohexylphenylketon umgesetzt. Das Keton reagiert anschließend mit 2-N-Piperidylethylmagnesiumchlorid in einer Grignard-Reaktion zu Trihexyphenidyl.

Stereochemie
Trihexyphenidyl enthält ein Stereozentrum und besteht aus einem Gemisch von zwei Enantiomeren. Hierbei handelt es sich um ein Racemat, also ein 1:1-Gemisch von (R)- und der (S)-Form:[4]
| Enantiomere von Trihexyphenidyl | |
|---|---|
-Trihexyphenidyl_Structural_Formula_V1.svg.png.webp) (R)-Trihexyphenidyl |
-Trihexyphenidyl_Structural_Formula_V1.svg.png.webp) (S)-Trihexyphenidyl |
Einzelnachweise
- Datenblatt DL-Trihexyphenidyl hydrochloride bei Sigma-Aldrich, abgerufen am 19. Februar 2018 (PDF).
- Trihexyphenidyl Oral Solution, abgerufen am 5. Februar 2018.
- J.C. Frölich, W. Kirch (Hrsg.): Praktische Arzneitherapie. Springer-Verlag, 2003, ISBN 978-3-540-01025-8, S. 909–910 (eingeschränkte Vorschau in der Google-Buchsuche).
- Rote Liste Service GmbH (Hrsg.): Rote Liste 2017 – Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte). Rote Liste Service GmbH, Frankfurt/Main, 2017, Aufl. 57, ISBN 978-3-946057-10-9, S. 224.