Thorium(IV)-fluorid
Thorium(IV)-fluorid ist eine anorganische chemische Verbindung des Thoriums aus der Gruppe der Fluoride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Th4+ _ F− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
I2/c (Nr. 15, Stellung 8) | |||||||||||||||
| Gitterparameter |
a = 1313 pm | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thorium(IV)-fluorid | |||||||||||||||
| Andere Namen |
Thoriumtetrafluorid | |||||||||||||||
| Verhältnisformel | ThF4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 308,03 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
6,32 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
1680 °C[2] | |||||||||||||||
| Brechungsindex |
1,52[3] | |||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||

Radioaktiv | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Thorium(IV)-fluorid kann durch Reaktion von Fluorwasserstoff mit Thorium(IV)-oxid bei 550 °C oder Thorium(IV)-hydrid bei 350 °C gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung durch Reaktion von Thorium(IV)-oxid mit Ammoniumhydrogendifluorid bei 500 °C.[1]
Auch aus Thorium und Fluor kann Thoriumfluorid gewonnen werden.[5]
Eigenschaften
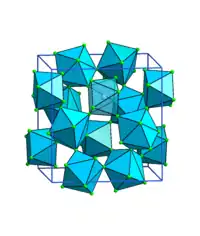
Thorium(IV)-fluorid ist ein weißer Feststoff, der in Form eines kryptokristallinen Pulvers oder einfachbrechenden, schillernden Kristallen vorliegt. Er ist unlöslich in Wasser und besitzt eine monokline Kristallstruktur mit der Raumgruppe I2/c (Raumgruppen-Nr. 15, Stellung 8) isotyp mit Zirconium(IV)-fluorid (a = 1313 pm, b = 1102 pm, c = 862 pm, β = 126°).[1] In der Kristallstruktur liegen quadratische Antiprismen ThF8 vor. Die Verbindung reagiert mit Luftfeuchtigkeit bei Temperaturen über 500 °C zu Thoriumoxidfluorid.[5] Bei Darstellung aus Lösungen liegt es in Form von Hydraten vor (Okta-, Tetra-, Dihydrat etc.) von denen das Hemihydrat das Einzige ist, von welchem die Struktur bekannt ist.[6] Das Kristallwasser kann aus dem Hemihydrat durch Erhitzung im Vakuum auf 400 °C entfernt werden.[7]
Verwendung
Thorium(IV)-fluorid wird zur Herstellung von reinem Thorium und Hochtemperaturkeramiken verwendet. Des Weiteren dient es als Sputtertarget zur Herstellung von Dünnschichten mit niedrigem Brechungsindex ohne Absorption im sichtbaren und UV-Bereich.[5] Es wird auch bei der Herstellung von Kohlebogenlampen verwendet.[8]
Darüber hinaus ist angedacht, Thorium(IV)-fluorid als Brennstoff für einen bestimmten Typ von Brutreaktor (Flüssigfluorid-Thorium-Reaktor, LFTR) zu nutzen. Erste Exemplare dieser Reaktoren sind seit 2010 in Japan und seit 2014 in China in der Entwicklung.[9]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 1135.
- William M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 93. Auflage. CRC Press, 2012, S. 95 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ronald R. Willey: Practical Design and Production of Optical Thin Films. CRC Press, 2002, S. 276 (eingeschränkte Vorschau in der Google-Buchsuche).
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Dale L. Perry: Handbook of Inorganic Compounds. 2. Auflage. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 426 (eingeschränkte Vorschau in der Google-Buchsuche).
- Lester R. Morss, Norman M. Edelstein, J. Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements (Set Vol.1-6). Springer, 2010, ISBN 978-94-007-0211-0, S. 79 (eingeschränkte Vorschau in der Google-Buchsuche).
- Advances in Inorganic Chemistry and Radiochemistry. Vol. 2. Academic Press, 1960, ISBN 0-08-057851-9, S. 208 (eingeschränkte Vorschau in der Google-Buchsuche).
- John J. McKetta Jr (Hrsg.): Thermoplastics to Trays (= Encyclopedia of Chemical Processing and Design. Volume 58). CRC Press, 1996, ISBN 0-8247-2609-X, S. 81 (eingeschränkte Vorschau in der Google-Buchsuche).
- Michael Odenwald: Garant für die Weltenergieversorgung. Focus online, 5. Mai 2011, Seite 3, abgerufen am 29. Mai 2014.