Zirconium(IV)-fluorid
Zirconium(IV)-fluorid ist eine anorganische chemische Verbindung des Zirconiums aus der Gruppe der Fluoride.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| _ Zr4+ _ F− | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
I2/c (Nr. 15, Stellung 8) | |||||||||
| Gitterparameter | ||||||||||
| Allgemeines | ||||||||||
| Name | Zirconium(IV)-fluorid | |||||||||
| Andere Namen |
Zirconiumtetrafluorid | |||||||||
| Verhältnisformel | ZrF4 | |||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 167,22 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte |
4,43 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Brechungsindex |
1,59[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Gewinnung und Darstellung
Zirconium(IV)-fluorid kann durch Reaktion von Zirconium(IV)-chlorid mit Fluorwasserstoff gewonnen werden.[4]
Ebenfalls möglich ist die Darstellung durch Reaktion von Zirconium(IV)-oxid mit Flusssäure[4]
oder thermische Zersetzung von (NH4)2ZrF6.[4]
Eigenschaften
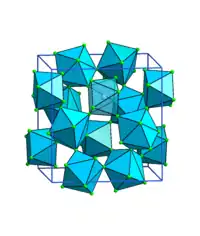
Zirconium(IV)-fluorid ist eine weiße, stark lichtbrechende, durchscheinende Masse, die schwer löslich in Wasser ist. Ab 50 °C aufwärts hydrolysiert die Verbindung in Wasser.[4] Das Anhydrat hat eine monokline Kristallstruktur mit der Raumgruppe I2/a (Raumgruppen-Nr. 15, Stellung 7), wobei außer der stabilen β-Form auch eine tetragonale α-Form (Raumgruppe P42/m (Nr. 84))[5] und eine γ-Form existieren.[6][7] Die β-Form besteht aus quadratischen Antiprismen ZrF8; jedes Fluoratom koordiniert dabei zwei Zirconiumatome. Das Trihydrat hat eine dimere Struktur mit trikliner Kristallstruktur.[8] Das Monohydrat hat eine tetragonale Kristallstruktur mit der Raumgruppe I42d (Nr. 122).[9]
Verwendung
Zirconium(IV)-fluorid wird als Rohstoff zur Herstellung von optischen Glasfasern und optischen Gläsern, insbesondere für die IR-Spektrometrie, verwendet.[10][11] Es wird auch als Beimischung zu Nuklearbrennstoffen verwendet.[12]
Einzelnachweise
- C. Legein, F Fayon, C. Martineau, M. Body, J.Y. Buzare, D. Massiot, E. Durand, A. Tressaud, A. Demourgues, O. Peron, B. Boulard: 19F high magnetic field NMR study of beta-ZrF4 and CeF4: From spectra reconstruction to correlation between fluorine sites and 19F isotopic chemical shifts. In: Inorganic Chemistry, 2006, 45(26), S. 10636–10641 doi:10.1021/ic061339a.
- Datenblatt Zirconium(IV) fluoride, 99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 13. Oktober 2013 (PDF).
- Datenblatt Zirconium(IV)-fluorid bei AlfaAesar, abgerufen am 13. Oktober 2013 (PDF) (JavaScript erforderlich).
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 260.
- R. Papiernik, D. Mercurio, B. Frit: Structure du tetrafluorure de zirconium, ZrF4 alpha. In: Acta Crystallographica, 1982, B38, S. 2347–2353 doi:10.1107/S0567740882008760
- Chemical Thermodynamics of Zirconium. Gulf Professional Publishing, 2005, ISBN 0-08-045753-3, S. 144 (eingeschränkte Vorschau in der Google-Buchsuche).
- Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 818 (eingeschränkte Vorschau in der Google-Buchsuche).
- R. L. Davidovich, M. A. Pushilin, V. B. Logvinova, A. V. Gerasimenko: Crystal structure of monoclinic modifications of zirconium and hafnium tetrafluoride trihydrates. In: Journal of Structural Chemistry. 54, 2013, S. 541–546, doi:10.1134/S0022476613030104.
- B. Kojic-Prodic, F. Gabela, Z. Ruzic-Toros, M. Sljukic: Structure of aquatetrafluorozirconium(IV). In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 37, S. 1963–1965, doi:10.1107/S0567740881007772.
- Catherine E. Housecroft: Inorganic Chemistry. Pearson Education, 2005, ISBN 0-13-039913-2, S. 652 (eingeschränkte Vorschau in der Google-Buchsuche).
- William S. Rees, Jr.: CVD of Nonmetals. John Wiley & Sons, 2008, ISBN 3-527-61480-X, S. 370 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dan Gabriel Cacuci: Handbook of Nuclear Engineering. Vol. 5: Fuel Cycles, Decommissioning, Waste Disposal and Safeguards. Springer, 2010, ISBN 0-387-98130-6, S. 2961 (eingeschränkte Vorschau in der Google-Buchsuche).
