Polythionsäuren
Polythionsäuren zählen zu den Sauerstoffsäuren des Schwefels mit der allgemeinen Summenformel H2S2+nO6 bzw. HO3S–Sn–SO3H (n = 1, 2, 3, … 11). Polythionsäuren sind in wässrigen Lösungen relativ beständig. Die Beständigkeit nimmt mit zunehmendem Schwefelgehalt ab. Die Beständigkeit ihrer Salze nimmt in saurer Lösung vom Tri- zum Hexathionat zu und zum Octathionat wieder ab. In alkalischer Lösung nimmt die Beständigkeit der Polythionate mit zunehmendem Schwefelgehalt ab.
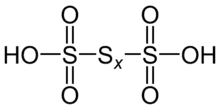
Darstellung
Durch Einleiten von Schwefelwasserstoff in eine Lösung von Schwefeldioxid (Schweflige Säure) erhält man eine farb- und geruchlose Lösung, die „Wackenrodersche Flüssigkeit“, die hauptsächlich Tetrathionsäure H2S4O6 und Pentathionsäure H2S5O6 enthält.
Bedeutung und Verwendung
Das Tetrathionat-Ion entsteht bei der Iodometrie.
Historisches
Bereits John Dalton hatte festgestellt, dass bei Mischungen der wässrigen Lösungen von Schwefeldioxid und Schwefelwasserstoff der Geruch beider Gasarten verschwindet, was eine chemische Reaktion wahrscheinlich macht. Er schrieb dazu: „Mischt man Wasser, welches mit jeder dieser Gasarten einzeln imprägnirt worden, zusammen, bis eine wechselseitige Sättigung statt findet, oder bis nach dem Schütteln der Geruch von keiner der Gasarten bemerkbar ist, so erhält man eine milchichte Flüssigkeit, welche man mehrere Wochen ohne merkliche Veränderung oder Neigung zur Präcipitation aufbewahren kann. Ihr Geschmack ist bitter und etwas sauer, und sehr von einer bloßen Mischung aus Schwefel und Wasser verschieden. Wird sie gekocht, so scheidet sich Schwefel aus, und man findet Schwefelsäure in der klaren Flüssigkeit.“[1] Heinrich Wilhelm Ferdinand Wackenroder untersuchte zusammen mit seinem Assistenten Hermann Ludwig (1819–1873) die wässrigen Lösungen und schlug zur Erklärung der Ergebnisse „eine neue Säure des Schwefels“ vor, die Pentathionsäure.[2][3] Danach wurden solche Lösungen Wackenrodersche Flüssigkeit genannt. Der Name setzte sich durch, obwohl Hermann Ludwig versuchte, auch seinen Namen mit der Pentathionsäure zu verknüpfen.[4]
Literatur
- Eintrag zu Polythionsäuren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
Einzelnachweise
- John Dalton, Friedrich Wolff, Ein neues System des chemischen Theiles der Naturwissenschaft, Julius Eduard Hitzig, Berlin 1813, Band 2, Seite 190, online bei Google Books.
- H. Wackenroder, Ueber eine neue Säure des Schwefels, Archiv der Pharmazie Band 97, Nr. 3 (1846) 272–288, doi:10.1002/ardp.18460970303, online im Internet Archive.
- H. Wackenroder, Bestimmung des Sauerstoffgehaltes der Pentathionsäure, Archiv der Pharmazie Band 98, Nr. 2 (1846), 140–151, doi:10.1002/ardp.18460980203, online bei der Bayerischen Staatsbibliothek.
- Hermann Ludwig, Zur Geschichte der Pentathionsäure, Archiv der Pharmazie Band 135, Nr. 1, Seiten 9–13, 1856, doi:10.1002/ardp.18561350105, online im Internet Archive.