Orthokohlensäuretetraethylester
Orthokohlensäuretetraethylester ist ein Orthokohlensäureester, der formal durch vollständige Ethylierung der in freiem Zustand instabilen Orthokohlensäure C(OH)4, entsteht. Orthokohlensäuretetraethylester C(OC2H5)4 wurde erstmals 1864 beschrieben.[2]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
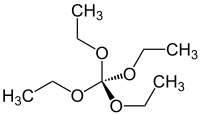 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Orthokohlensäuretetraethylester | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C9H20O4 | |||||||||||||||
| Kurzbeschreibung |
klare, farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 192,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,91 g·cm−3 (20 °C)[1] | |||||||||||||||
| Siedepunkt |
158–159 °C[1] | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (20 °C)[1] | |||||||||||||||
| Brechungsindex |
1,3932 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Die Darstellung des Orthokohlensäuretetraethylesters aus dem hochgiftigen und als chemischer Kampfstoff im Ersten Weltkrieg eingesetzten Chlorpikrin ist literaturbekannt[2][3][4][5] und erreicht lediglich Ausbeuten von 46–49 %[4] bis 58 % d.Th.[5]
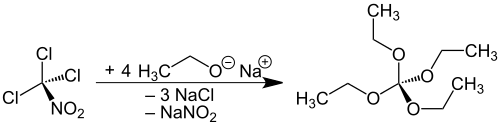
Der wie beim homologen Orthokohlensäuretetramethylester naheliegende Syntheseweg aus Tetrachlorkohlenstoff liefert nicht das gewünschte Produkt.[6]
Ausgehend vom im Vergleich zu Chlorpikrin weniger giftigen Trichloracetonitril können wie beim Orthokohlensäuretetraethylester deutlich (bis 85 % d.Th.) höhere Ausbeuten erzielt werden.[7] Eine Alternative unter Umgehung problematischer Reaktanden stellt die Umsetzung von Dialkylzinn-dialkoxiden mit Schwefelkohlenstoff bei erhöhter Temperatur im Autoklaven dar:[8]
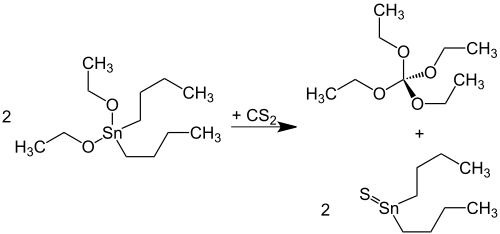
Eine neuere Synthese geht direkt von Natriumethanolat, Zinn(IV)-chlorid und Schwefelkohlenstoff aus.[9]
Eigenschaften
Orthokohlensäuretetraethylester ist eine wasserklare, aromatisch bzw. fruchtig[10] riechende Flüssigkeit, die unverträglich gegenüber starken Säuren und starken Basen ist.[11]
Verwendung
Orthokohlensäuretetraethylester kann als Lösungsmittel und zur Alkylierung CH-azider Verbindungen, z. B. Phenolen und Carbonsäuren eingesetzt werden. Daneben reagiert es mit Aminen, Enolethern, Sulfonamiden u. ä.,[12] wobei auch Spiroverbindungen erhalten werden können. Von gewissem industriellem Interesse sind Spiro-orthocarbonate (SOCs),[13] die als Additive zur Verminderung der Schrumpfung bei der Polymerisation von Epoxiden Verwendung finden.[14]
Einzelnachweise
- Datenblatt Tetraethylcarbonat zur Synthese (PDF) bei Merck, abgerufen am 17. Oktober 2013.
- H. Bassett, Ueber das vierfach-basische kohlensaure Aethyl, Ann. 132, 54 (1864), doi:10.1002/jlac.18641320106.
- H. Tieckelmann, H.W. Post, The preparation of methyl, ethyl, propyl, and butyl orthocarbonates, J. Org. Chem., 13 (2), 265–267 (1948), doi:10.1021/jo01160a014.
- J.D. Roberts, R.E. McMahon: Ethyl Orthocarbonate In: Organic Syntheses. 32, 1952, S. 68, doi:10.15227/orgsyn.032.0068; Coll. Vol. 4, 1963, S. 457 (PDF).
- Europäische Patentschrift EP 0881212 B1, Production method of aminobenzene compound, Erfinder: H. Hashimoto et al., Anmelder: Takeda Chemical Industries, Ltd., veröffentlicht am 30. Oktober 2001.
- R.H. De Wolfe, Carboxylic ortho acid derivatives: preparation and synthetic applications, Organic Chemistry, Vol. 14, Academic Press, Inc. New York – London, 1970, ISBN 978-0-12-214550-6.
- US-Patent US 6825385, Process for the preparation of orthocarbonates, Erfinder: G. Fries, J. Kirchhoff, Anmelder: Degussa AG, erteilt am 30. November 2004.
- S. Sakai et al., Reaction of Dialkyltin Dialkoxides with Carbon Disulfide at Higher Temperature. Preparation of Orthocarbonates, J. Org. Chem., 36 (9), 1176 (1971), doi:10.1021/jo00808a002.
- S. Sakai et al., A new method for preparation of tetraalkyl orthocarbonates from sodium alkoxides, tetrachlorostannane, and carbon disulfide, Synthesis 1984 (3), 233–234, doi:10.1055/s-1984-30785.
- J. H. Ruth, Odor Thresholds and Irritation Levels of Several Chemical Substances: A Review, Am. Ind. Hyg. Assoc. J. 47, A-142 – A-151, (1986).
- Datenblatt Orthokohlensäuretetraethylester bei Sigma-Aldrich, abgerufen am 17. Oktober 2013 (PDF).
- W. Kantlehner et al., Die präparative Chemie der O- und N-funktionellen Orthokohlensäure-Derivate, Synthesis, 1977, 73–90.
- D.T. Vodak et al., One-Step Synthesis and Structure of an Oligo(spiro-orthocarbonate), J. Am. Chem., Soc., 124, 4942–4943 (2002), doi:10.1021/ja17683i.
- R. Acosta Ortiz et al., Novel diol spiro orthocarbonates derived from glycerol as anti-shrinkage additives for the cationic photopolymerization of epoxy monomers, Polymer International, 59(5), 680–685 (2010), doi:10.1002/pi.2755.
