Tafamidis
Tafamidis (Handelsname Vyndaqel; Hersteller Pfizer) ist ein Arzneistoff aus der Gruppe der pharmakologischen Chaperone, der in der Behandlung der Transthyretin-Amyloidose (ATTR) eingesetzt wird, um das Fortschreiten der Erkrankung zu verzögern. Tafamidis stabilisiert das Protein Transthyretin und verlangsamt dadurch die Entstehung von Amyloiden, deren Ablagerung im Gewebe für die krankheitsbedingten Folgeschäden verantwortlich ist. In der EU ist Tafamidis zugelassen zur Behandlung der ATTR mit Kardiomyopathie (ATTR-CM) oder mit Polyneuropathie (ATTR-PN). Es kann sowohl bei genetisch bedingten Formen der ATTR wie der familiären Amyloidpolyneuropathie Typ I als auch bei Wildtyp-ATTR eingesetzt werden.[2][3]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
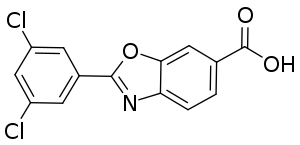 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tafamidis | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C14H7Cl2NO3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N07XX08 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Transthyretin-Stabilisierung | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 308,11 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Tafamidis ist ein Orphan-Arzneimittel, d. h. ein Arzneimittel gegen eine seltene Erkrankung. Als Transthyretin-Stabilisator gilt es als First-in-class-Medikament in der Behandlung der ATTR-CM.
Klinische Angaben
Anwendungsgebiete
Tafamidis ist in zwei verschiedenen Dosierungen und galenischen Formen zur Behandlung von zwei separaten Formen der ATTR zugelassen:
- In der Formulierung als freie Säure in einer Dosierung von 61 mg je Kapsel ist Tafamidis in der EU zugelassen zur Behandlung der Transthyretin-Amyloidose bei erwachsenen Patienten mit Kardiomyopathie (ATTR-CM).[3]
- In der Formulierung als Tafamidis-Meglumin, d. h. als Meglumin-Salz, ist Tafamidis in einer Dosierung von 20 mg Tafamidis-Meglumin je Kapsel in der EU zugelassen zur Behandlung der Transthyretin-Amyloidose bei erwachsenen Patienten mit symptomatischer Polyneuropathie (ATTR-PN) im Stadium 1, um die Einschränkung der peripheren neurologischen Funktionsfähigkeit zu verzögern.[2]
Tafamidis als freie Säure und Tafamidis-Meglumin sind nicht ohne weiteres gegeneinander austauschbar. Eine Kapsel mit 61 mg Tafamidis als freie Säure entspricht einer Dosis von 80 mg Tafamidis-Meglumin, während umgekehrt eine Kapsel mit 20 mg Tafamidis-Meglumin einer Dosis von 12,2 mg Tafamidis als freie Säure entspricht. Zudem unterscheiden sich Tafamidis als freie Säure und Tafamidis-Meglumin in Bezug auf ihre pharmakokinetischen Eigenschaften.[2][3] Tafamidis als freie Säure wird in einigen Ländern unter dem Handelsnamen Vyndamax vermarktet, beispielsweise in den USA.[4] Hingegen werden in der EU Tafamidis als freie Säure und Tafamidis-Meglumin unter dem gleichen Handelsnamen Vyndaqel vermarktet.[2][3]
Bei Patienten mit Herzinsuffizienz oder Kardiomyopathie, bei denen ein Verdacht auf ATTR-CM besteht, muss vor Beginn einer Behandlung mit Tafamidis die Diagnose der ATTR-CM bestätigt und eine AL-Amyloidose (primäre Amyloidose) ausgeschlossen worden sein.[3]
Art und Dauer der Anwendung
Die empfohlene Dosierung entspricht einer Kapsel zum Schlucken einmal täglich. Dies gilt in der jeweiligen Indikation sowohl für Tafamidis als freie Säure (61 mg) als auch für Tafamidis-Meglumin (20 mg).[2][3]
Die Kapseln müssen im Ganzen geschluckt werden und dürfen nicht zerdrückt oder durchgeschnitten werden. Tafamidis kann mit oder ohne Nahrung eingenommen werden.[2][3]
Die Behandlung einer ATTR-CM mit Tafamidis sollte so früh wie möglich im Verlauf der Erkrankung begonnen werden, solange eine Verzögerung des Krankheitsfortschritts noch einen deutlichen Nutzen erbringt. Bei einer bereits weiter fortgeschrittenen Amyloid-bedingten Herzschädigung, z. B. bei Herzinsuffizienz der NYHA-Klasse III, liegt die Entscheidung über die Einleitung oder Fortsetzung einer Therapie mit Tafamidis im ärztlichen Ermessen.[3]
Gegenanzeigen
Eine Gegenanzeige für die Behandlung besteht bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels.[2][3]
Wechselwirkungen mit anderen Medikamenten
Tafamidis hemmt den Efflux-Transporter BCRP (Breast Cancer Resistance Protein) und könnte mit dessen Substraten interagieren, z. B. Methotrexat, Rosuvastatin und Imatinib. Darüber hinaus hemmt Tafamidis die Aufnahmetransporter OAT1 und OAT3 (organische Anionen-Transporter), jedoch wird basierend auf In-vitro-Daten nicht davon ausgegangen, dass diese Hemmung zu klinisch signifikanten Wechselwirkungen führt. Tafamidis scheint keinen Einfluss auf Cytochrom P450 3A4 (CYP3A4) zu haben. Zur Wirkung anderer Arzneimittel auf Tafamidis wurden keine Wechselwirkungsstudien durchgeführt.[2][3]
Tafamidis kann die Serumkonzentrationen des Gesamt-Thyroxins verringern, ohne dass gleichzeitig Veränderungen des freien Thyroxins (T4) oder des Thyreotropins (TSH) auftreten. Dies ist wahrscheinlich das Ergebnis einer reduzierten Bindung von Thyroxin an oder dessen Verdrängung von Transthyretin (TTR) aufgrund der hohen Bindungsaffinität von Tafamidis an den TTR-Thyroxin-Rezeptor. Es gibt keine Hinweise auf eine Schilddrüsenfunktionsstörung.[2][3]
Anwendung während Schwangerschaft und Stillzeit
Frauen im gebärfähigen Alter müssen während der Behandlung mit Tafamidis sowie für einen Monat nach Behandlungsende eine wirksame Verhütung anwenden.[2][3]
Bisher liegen keine Erfahrungen mit der Anwendung von Tafamidis bei Schwangeren vor. Tierexperimentelle Studien haben eine Entwicklungstoxizität gezeigt. Die Anwendung von Tafamidis während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, wird nicht empfohlen.[2][3]
Tafamidis soll während der Stillzeit nicht angewendet werden, da es voraussichtlich in die Milch übergeht und da ein Risiko für das Kind nicht ausgeschlossen werden kann.[2][3]
In nicht klinischen Studien wurde keine Beeinträchtigung der Fertilität beobachtet.[2][3]
Eingeschränkte Leber- und Nierenfunktion
Bei Patienten mit eingeschränkter Nierenfunktion oder leichter bis mäßiger Einschränkung der Leberfunktion ist keine Dosisanpassung erforderlich. Es liegen begrenzte Daten zu Patienten mit starker Einschränkung der Nierenfunktion (Kreatinin-Clearance ≤ 30 ml/min) vor. Tafamidis wurde nicht an Patienten mit schwerer Beeinträchtigung der Leberfunktion untersucht, sodass bei diesen Patienten Vorsicht geboten ist.[2][3]
Kinder und Jugendliche
Es gibt keinen relevanten Nutzen von Tafamidis bei Kindern und Jugendlichen,[2][3] da die Krankheit typischerweise erst im Erwachsenenalter ausbricht.
Patienten nach Organtransplantation
Im Rahmen der Standardtherapie der ATTR kann eine Organtransplantation notwendig sein. Dies kann eine Lebertransplantation sein, da Transthyretin in der Leber produziert wird, oder bei Patienten mit ATTR-CM eine Herztransplantation, wenn eine akute Herzinsuffizienz („Herzversagen“) droht. Nach einer Lebertransplantation (ATTR-PN) bzw. Organtransplantation (ATTR-CM) sollte Tafamidis abgesetzt werden.[2][3]
Tafamidis-Meglumin (20 mg) bei ATTR-PN
Nebenwirkungen von Tafamidis-Meglumin (20 mg) bei Patienten mit ATTR-PN sind allgemein leicht bis mittelschwer ausgeprägt. Sehr häufig, d. h. bei mindestens einem von zehn Patienten, wurden folgende Nebenwirkungen beobachtet: Harnwegsinfekte, Vaginalinfekte, Diarrhoe oder Oberbauchschmerzen. Dieses Sicherheitsprofil basiert auf den klinischen Daten von 127 Patienten mit ATTR-PN, die im Rahmen klinischer Studien über durchschnittlich 538 Tage einmal täglich Tafamidis-Meglumin (20 mg) erhielten.[2]
Tafamidis (61 mg) bei ATTR-CM
Unerwünschte Ereignisse traten bei Behandlung mit Tafamidis und bei Placebo in einer klinischen Studie etwa vergleichbar häufig auf. Ein ursächlicher Zusammenhang zwischen der Behandlung mit Tafamidis und dem Auftreten unerwünschter Ereignisse wurde nicht festgestellt. Dieses Sicherheitsprofil basiert auf den klinischen Daten von 176 Patienten mit ATTR-CM, die im Rahmen einer klinischen Studie über durchschnittlich 30 Monate einmal täglich Tafamidis-Meglumin (80 mg, Gabe als 4 × 20 mg) erhielten, was einer Dosis von 61 mg Tafamidis als freie Säure entspricht.[3][5]
Pharmakologische Eigenschaften
Wirkungsmechanismus

Tafamidis ist ein pharmakologisches Chaperon, das als selektiver Stabilisator des Transthyretins (TTR) wirkt. Tafamidis bindet die Thyroxin-Bindungsstellen des TTR und stabilisiert dadurch das TTR-Tetramer. Dies verlangsamt dessen Spaltung in Monomere und dadurch die Entstehung von Amyloiden, deren Ablagerungen im Gewebe die Ursache für die krankheitsbedingten Folgeschäden wie Neuropathie und Herzschädigung ist.[2][3] Das Voranschreiten der Krankheit wird dadurch verlangsamt.[6]
Tafamidis stabilisiert sowohl das Wildtyp-TTR-Tetramer als auch die Tetramere von 14 TTR-Varianten einschließlich V30M (Val30Met), F64S, Y69H, I84S, L111M und V122I.[2][3][7]
Resorption
Der maximale Plasmaspiegel (Cmax) wird innerhalb von 4 Stunden nach der Einnahme erreicht. Die gleichzeitige Einnahme einer fett- und kalorienreichen Mahlzeit ändert die Geschwindigkeit, nicht aber das Ausmaß der Resorption. Tafamidis kann daher mit oder ohne Nahrung eingenommen werden.[2][3]
Verteilung
Tafamidis wird im Plasma nahezu vollständig an Proteine gebunden. Die Affinität von Tafamidis zu TTR ist höher als zu Albumin und Tafamidis bindet im Plasma bevorzugt an TTR.[2][3]
Biotransformation und Elimination
Präklinische Daten weisen darauf hin, dass Tafamidis über Glucuronidierung metabolisiert und über die Galle ausgeschieden wird. Etwa 59 % der eingenommenen Gesamtdosis wurden im Stuhl und etwa 22 % im Urin nachgewiesen. Die mittlere biologische Halbwertszeit liegt bei ca. 49 Stunden.[2][3]
Sonstige Informationen
Präklinische Daten zur Sicherheit
Präklinische Daten lassen keine besonderen Gefahren für den Menschen erkennen.[2][3]
Geschichtliches
Grundlage für die Entwicklung von Tafamidis war unter anderem eine Beobachtung an einigen portugiesischen Patienten mit ATTR-PN, die unerwartet milde Symptome zeigten. Eine molekulargenetische Untersuchung dieser Patienten zeigte neben der für die Erkrankung ursächlichen Mutation des TTR-Gens, welche den Aminosäurenaustausch V30M zur Folge hat, eine zweite Mutation auf dem zweiten TTR-Allel, welche den Austausch T119M zur Folge hat.[8][9] Die so entstehenden Heterotetramere aus TTR-V30M und TTR-T119M sind stabiler als Tetramere aus TTR-V30M und Wildtyp-TTR, wodurch sich weniger TTR-Monomere und somit weniger TTR-Amyloidplaques bilden.[10]
Diese Beobachtung diente als Ansatzpunkt für ein strukturbasiertes Wirkstoffdesign zur Entwicklung eines Medikaments, das die Bindungsaffinität der TTR-Monomere erhöht und somit die Wahrscheinlichkeit für deren Dissoziation verringert. Ein Wirkstoffscreening von entsprechenden Benzoxazol-Verbindungen im Labor von Jeffery Kelly, dessen Ergebnisse im Jahr 2003 veröffentlicht wurden, zeigte Tafamidis als vielversprechenden Kandidaten.[11] Zur Weiterentwicklung und Vermarktung von Tafamidis als Medikament gründete Kelly zusammen mit Susan Lindquist die Firma FoldRx, die im Jahr 2010 von Pfizer übernommen wurde.
Die Marktzulassung von Tafamidis zur Behandlung der ATTR-PN erfolgte in der EU im Jahr 2011 auf Grundlage der Studien Fx-005, Fx-006 und Fx1A-201.[12][13] In den USA wurde Tafamidis zur Behandlung der ATTR-PN bislang nicht zugelassen. Die zuständige Zulassungsbehörde FDA begründete ihre entsprechende Entscheidung im Jahr 2012 damit, dass die Zulassungsstudie Fx-005 ihre primären Endpunkte verfehlt hatte und dass weitere Daten zur Wirksamkeit von Tafamidis bei ATTR-PN benötigt werden.[14] Die Marktzulassung von Tafamidis zur Behandlung der ATTR-CM erfolgte in den USA im Jahr 2019 und in der EU im Jahr 2020 auf Grundlage der Studie ATTR-ACT.[4][12]
Fx-005
In der Studie Fx-005 (B3461020) wurde die Sicherheit und Wirksamkeit von Tafamidis bei ATTR-PN im Vergleich zu Placebo untersucht. Es handelte sich um eine 18-monatige, multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie. Eine Behandlung mit Tafamidis-Meglumin (20 mg) wurde im Vergleich zu Placebo bei insgesamt 128 Patienten mit ATTR-PN und V30M-Mutation des TTR-Gens untersucht, die sich vorwiegend im Stadium 1 der Erkrankung befanden. Primäre Endpunkte waren der NIS-LL-Score als Maß für die neurologische Funktion der Beine, ermittelt anhand ärztlicher neurologischer Untersuchung, sowie der NORFOLK-QOL-DN-Score als Maß für die Lebensqualität, ermittelt anhand eines vom Patienten ausgefüllten Fragebogens. Weitere Endpunkte waren ein zusammengesetzter Score zur Funktion großer und kleiner Nervenfasern sowie eine Beurteilung des Ernährungszustandes.
Nach Ende der 18-monatigen Studiendauer zeigten sich in der Intention-to-treat-Analyse keine signifikanten Unterschiede zwischen den Behandlungsgruppen in Bezug auf die primären Endpunkte. Da im Verlauf der Studie in beiden Behandlungsarmen mehr Patienten als erwartet vorzeitig ausgeschieden waren, mehrheitlich um sich einer Lebertransplantation zur Behandlung ihrer ATTR zu unterziehen, wurden in einer Per-Protokoll-Analyse nur die Daten derjenigen 87 Patienten berücksichtigt, die die Studie protokollgemäß abgeschlossen hatten. In dieser Analyse zeigte sich ein statistisch signifikanter Vorteil für Tafamidis in Bezug auf die primären Endpunkte NIS-LL- und NORFOLK-QOL-DN-Score sowie in Bezug auf die meisten sekundären Endpunkte.[15][16]
Die Zulassung von Tafamidis in der EU zur Behandlung der ATTR-PN erfolgte auf Grundlage der Studie Fx-005 als Schlüsselstudie, unterstützt durch die Studien Fx-006 und Fx1A-201.[12] Hingegen wurde Tafamidis in den USA zur Behandlung der ATTR-PN bislang nicht zugelassen. Aus Sicht der zuständigen Zulassungsbehörde FDA waren die Ergebnisse der Studie Fx-005 unzureichend für einen Nachweis der Wirksamkeit von Tafamidis bei ATTR-PN, da die Studie ihre primären Endpunkte verfehlt hatte.[14]
Fx-006
Fx-006 (B3461021) war eine 12-monatige, unverblindete Verlängerungsstudie zu Fx-005. An der Studie nahmen 86 Patienten mit ATTR-PN und V30M-Mutation teil, die zuvor im Rahmen der Studie Fx-005 entweder Tafamidis oder Placebo erhalten hatten. In der Verlängerungsstudie erhielten nun alle Patienten Tafamidis, auch diejenigen, die zuvor Placebo erhalten hatten.
Nach Wechsel von Placebo zu Tafamidis verlangsamte sich das Voranschreiten der Krankheit. Bei Patienten, die bereits zuvor Tafamidis erhalten hatten, wurde diesbezüglich keine signifikante Veränderung festgestellt. Ebenso wurden keine neuen Nebenwirkungen beobachtet.[17][18]
Fx1A-201
In der Studie Fx1A-201 (B3461022) wurde Tafamidis bei ATTR-PN ohne V30M-Mutation untersucht. Es handelte sich um eine 12-monatige, multizentrische, einarmige, unverblindete Phase-II-Studie. Teilnehmer waren 21 Patienten mit insgesamt acht verschiedenen TTR-Mutationen.
Der primäre Endpunkt, eine Stabilisierung von TTR nach sechs Wochen, wurde bei allen bis auf einen Patienten erreicht. Nach sechs und zwölf Monaten wurde bei allen Patienten eine TTR-Stabilisierung erreicht. Darüber hinaus wurden als explorative Endpunkte unter anderem die neurologische Funktion der Beine (NIS-Score) und die Lebensqualität (NORFOLK-QOL-DN-Score) untersucht. Nach zwölf Monaten wurden teilweise eine Verschlechterung der neurologischen Funktion und ein Erhalt der Lebensqualität beobachtet. Die Verträglichkeit der Behandlung wurde von den Autoren als gut beschrieben.[19][20]
Fx1A-303
Fx1A-303 (B3461023) war eine weitere, langfristig angelegte Verlängerungsstudie zu Tafamidis bei ATTR-PN. Es handelte sich um eine bis zu 10-jährige, multizentrische, einarmige, unverblindete Phase-III-Studie. Teilnehmen konnten Patienten mit ATTR-PN, die zuvor bereits an der Studie Fx-006 (Patienten mit V30M-Mutation) oder Fx1A-201 (Patienten ohne V30M-Mutation) teilgenommen hatten. Primäre Endpunkte waren neben neurologischer Funktion der Beine (NIS-Score) und Lebensqualität (NORFOLK-QOL-DN-Score) auch die Fähigkeit zu Aktivität, Selbstversorgung und Selbstbestimmung (Karnofsky-Index) sowie die Gehfähigkeit. Die Studie wurde im August 2020 abgeschlossen. Die abschließende Veröffentlichung der Studienergebnisse zu den primären Endpunkten steht mit Stand Juni 2021 noch aus.[21]
Fx1B-201
In der Studie Fx1B-201 (B3461025) wurde die TTR-Stabilisierung durch Tafamidis bei ATTR-CM im Vergleich zu Placebo untersucht. Es handelte sich um eine 12-monatige, multizentrische, einarmige, unverblindete Phase-II-Studie. Eine Behandlung mit Tafamidis-Meglumin (20 mg) wurde bei insgesamt 35 Patienten mit ATTR-CM untersucht, davon 31 mit Wildtyp-TTR und 4 mit der TTR-Mutation V122I. Die Patienten waren mindestens 40 Jahre alte Männer oder postmenopausale Frauen. Primärer Endpunkt war die Stabilisierung von TTR nach 6 Wochen, sekundärer Endpunkt nach 6 und 12 Wochen. Darüber hinaus wurden kardiovaskuläre Endpunkte untersucht.
Von den Patienten mit Wildtyp-TTR erreichten 97 % den primären und 89 % den sekundären Endpunkt. Von den Patienten mit der TTR-Mutation V122I erreichten alle den primären und 75 % den sekundären Endpunkt. Bei etwa der Hälfte der Patienten mit Wildtyp-TTR kam es innerhalb von 12 Monaten zu einer Progression der Erkrankung nach Definition der Studie.[22][23]
ATTR-ACT
In der Studie ATTR-ACT (B3461028) wurde die Sicherheit und Wirksamkeit von Tafamidis bei ATTR-CM im Vergleich zu Placebo untersucht. Es handelte sich um eine 30-monatige, multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie. Eine Behandlung mit Tafamidis wurde im Vergleich zu Placebo bei insgesamt 441 Patienten im Alter von 18–90 Jahren mit ATTR-CM (Wildtyp-TTR oder TTR-Mutation) untersucht. Die Patienten wurden randomisiert im Verhältnis 2:1:2 einer Behandlung mit 80 mg Tafamidis-Meglumin, 20 mg Tafamidis-Meglumin oder Placebo zugeordnet. Primäre Endpunkte waren Gesamtmortalität und kardiovaskulär bedingte Hospitalisierungen, wobei die Gesamtmortalität als wichtigerer Endpunkt angesehen wurde. Sekundäre Endpunkte waren unter anderem Gehfähigkeit und Gesundheitszustand.
Die Behandlung mit Tafamidis reduzierte die Gesamtmortalität und die Häufigkeit kardiovaskulär bedingter Hospitalisierungen signifikant um jeweils etwa 30 % gegenüber Placebo. Gehfähigkeit und Gesundheitszustand blieben unter Tafamidis signifikant besser erhalten als unter Placebo. Die Häufigkeit und Art unerwünschter Ereignisse war unter Tafamidis und unter Placebo ähnlich.[24][5]
Die Studie ATTR-ACT war eine Schlüsselstudie, auf Grundlage von deren Ergebnissen die Zulassung von Tafamidis zur Behandlung von ATTR-CM in der EU und in den USA erfolgte.[4][12]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Fachinformation Tafamidis-Meglumin 20 mg Weichkapseln, Stand Oktober 2020. (PDF) Abgerufen am 2. Juni 2021.
- Fachinformation Tafamidis 61 mg Weichkapseln, Stand Oktober 2020. (PDF) Abgerufen am 2. Juni 2021.
- Food and Drug Administration: Drug Approval Package: Vyndaqel & Vyndamax. (PDF) 3. Mai 2019, abgerufen am 2. Juni 2021.
- Mathew S Maurer, Jeffrey H Schwartz, Balarama Gundapaneni, Perry M Elliott, Giampaolo Merlini, Marcia Waddington-Cruz, Arnt V Kristen, Martha Grogan, Ronald Witteles, Thibaud Damy, Brian M Drachman, Sanjiv J Shah, Mazen Hanna, Daniel P Judge, Alexandra I Barsdorf, Peter Huber, Terrell A Patterson, Steven Riley, Jennifer Schumacher, Michelle Stewart, Marla B Sultan, Claudio Rapezzi, ATTR-ACT Study Investigators: Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. In: N Engl J Med. Band 379, Nr. 11, 13. September 2018, S. 1007–1016, doi:10.1056/NEJMoa1805689, PMID 30145929.
- Teresa Coelho, Giampaolo Merlini, Christine E Bulawa, James A Fleming, Daniel P Judge, Jeffery W Kelly, Mathew S Maurer, Violaine Planté-Bordeneuve, Richard Labaudinière, Rajiv Mundayat, Steve Riley, Ilise Lombardo, Pedro Huertas: Mechanism of Action and Clinical Application of Tafamidis in Hereditary Transthyretin Amyloidosis. In: Neurol Ther. Band 5, Nr. 1, 2016, S. 1–25, doi:10.1007/s40120-016-0040-x, PMID 26894299, PMC 4919130 (freier Volltext).
- Christine E Bulawa, Stephen Connelly, Michael Devit, Lan Wang, Charlotte Weigel, James A Fleming, Jeff Packman, Evan T Powers, R Luke Wiseman, Theodore R Foss, Ian A Wilson, Jeffery W Kelly, Richard Labaudinière: Tafamidis, a potent and selective transthyretin kinetic stabilizer that inhibits the amyloid cascade. In: PNAS. Band 109, Nr. 24, 12. Juni 2012, S. 9629–9634, doi:10.1073/pnas.1121005109, PMID 22645360, PMC 3386102 (freier Volltext).
- T. Coelho, M. Carvalho, M. J. Saraiva, I. Alves, M. R. Almeida, P. P. Costa: A strikingly benign evolution of FAP in an individual found to be a compound heterozygote for two TTR mutations: TTR MET 30 and TTR MET 119. In: J Rheumatol. Band 20, 1993, S. 179.
- Teresa Coelho, R. Chorão, A. Sousa, I. Alves, M. F. Torres, M. J. M. Saraiva: Compound heterozygotes of transthyretin Met30 and transthyretin Met119 are protected from the devastating effects of familial amyloid polyneuropathy. In: Neuromusc Disord. Band 6, S1, 1996, S. 20, doi:10.1016/0960-8966(96)88826-2.
- Márcia Waddington Cruz, Merril D Benson: A Review of Tafamidis for the Treatment of Transthyretin-Related Amyloidosis. In: Neurol Ther. Band 4, Nr. 2, 2015, S. 61–79, doi:10.1007/s40120-015-0031-3, PMID 26662359.
- Hossein Razavi, Satheesh K Palaninathan, Evan T Powers, R Luke Wiseman, Hans E Purkey, Nilofar N Mohamedmohaideen, Songpon Deechongkit, Kyle P Chiang, Maria T A Dendle, James C Sacchettini, Jeffery W Kelly: Benzoxazoles as Transthyretin Amyloid Fibril Inhibitors: Synthesis, Evaluation, and Mechanism of Action. In: Angew Chem Int Ed Engl. Band 42, Nr. 24, 2003, S. 2758–2761, doi:10.1002/anie.200351179, PMID 12820260.
- European Medicines Agency: Vyndaqel. Abgerufen am 2. Juni 2021.
- Gerard Said, Seden Grippon, Peter Kirkpatrick: Tafamidis. In: Nat Rev Drug Discov. Band 11, Nr. 3, 2012, S. 185–186, doi:10.1038/nrd3675, PMID 22378262.
- Kevin Grogan: FDA rejects Pfizer rare disease drug tafamidis. In: PharmaTimes online. 19. Juni 2012, abgerufen am 2. Juni 2021.
- NCT00409175 Safety and Efficacy Study of Fx-1006A in Patients With Familial Amyloidosis ClinicalTrials.gov
- Teresa Coelho, Luis F Maia, Ana Martins da Silva, Marcia Waddington Cruz, Violaine Planté-Bordeneuve, Pierre Lozeron, Ole B Suhr, Josep M Campistol, Isabel Maria Conceição, Hartmut H-J Schmidt, Pedro Trigo, Jeffery W Kelly, Richard Labaudinière, Jason Chan, Jeff Packman, Amy Wilson, Donna R Grogan: Tafamidis for transthyretin familial amyloid polyneuropathy: a randomized, controlled trial. In: Neurology. Band 79, Nr. 8, 21. August 2012, S. 785–792, doi:10.1212/WNL.0b013e3182661eb1, PMID 22843282.
- NCT00791492 An Extension of Study Fx-005 Evaluating Long-Term Safety And Clinical Outcomes Of Fx-1006A In Patients With Transthyretin Amyloid Polyneuropathy ClinicalTrials.gov
- Teresa Coelho, Luis F Maia, Ana Martins da Silva, Márcia W Cruz, Violaine Planté-Bordeneuve, Ole B Suhr, Isabel Conceiçao, Hartmut H-J Schmidt, Pedro Trigo, Jeffery W Kelly, Richard Labaudinière, Jason Chan, Jeff Packman, Donna R Grogan: Long-term effects of tafamidis for the treatment of transthyretin familial amyloid polyneuropathy. In: Journal of Neurology. Band 260, Nr. 11, 2013, S. 2802–2814, doi:10.1007/s00415-013-7051-7, PMID 23974642, PMC 23974642 (freier Volltext).
- NCT00630864 The Effects of Fx-1006A on Transthyretin Stabilization and Clinical Outcome Measures in Patients With Non-V30M Transthyretin Amyloidosis ClinicalTrials.gov
- Giampaolo Merlini, Violaine Planté-Bordeneuve, Daniel P Judge, Hartmut Schmidt, Laura Obici, Stefano Perlini, Jeff Packman, Tara Tripp, Donna R Grogan: Effects of tafamidis on transthyretin stabilization and clinical outcomes in patients with non-Val30Met transthyretin amyloidosis. In: J Cardiovasc Transl Res. Band 6, Nr. 6, Dezember 2013, S. 1011–1020, doi:10.1007/s12265-013-9512-x, PMID 24101373, PMC 3838581 (freier Volltext).
- NCT00925002 Safety And Efficacy Evaluation Of Fx-1006A In Subjects With Transthyretin Amyloidosis ClinicalTrials.gov
- NCT00694161 Safety and Efficacy of Tafamidis in Patients With Transthyretin Cardiomyopathy (ATTR-ACT) ClinicalTrials.gov
- Mathew S. Maurer, Donna R. Grogan, Daniel P. Judge, Rajiv Mundayat, Jeff Packman, Ilise Lombardo, Arshed A. Quyyumi, Janske Aarts, and Rodney H. Falk: Tafamidis in transthyretin amyloid cardiomyopathy: effects on transthyretin stabilization and clinical outcomes. In: Circ Heart Fail. Band 8, Nr. 3, Mai 2015, S. 519–526, doi:10.1161/CIRCHEARTFAILURE.113.000890, PMID 25872787.
- NCT01994889 Safety and Efficacy of Tafamidis in Patients With Transthyretin Cardiomyopathy (ATTR-ACT) ClinicalTrials.gov