Silibinin
Silibinin, auch Silybin, ist die am stärksten pharmakologisch aktive Substanz des Stoffkomplexes Silymarin, der aus den Früchten der Mariendistel (Silybum marianum) gewonnen wird. Sie gilt als Leitsubstanz für arzneilich verwendete Mariendistel-Früchte-Extrakte, die im Wirkstoffgehalt auf Silibinin normiert werden. Mariendistel-Früchte-Extrakt wirkt leberschützend und stärkt die Funktion der Leber.[4]

| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
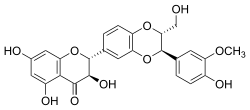 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Silibinin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C25H22O10 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A05BA03 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 482,44 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Beschreibung und Wirkmechanismen
Chemisch gesehen ist Silibinin ein Diastereomerengemisch bestehend aus Silybin A und Silybin B, die sich durch die Konfiguration am C-2″ und C-3″ unterscheiden.
Isoliertes Silibinin wird in der Therapie der Lebervergiftung durch Giftstoffe des Knollenblätterpilzes (Amatoxine) wie etwa Amanitin und Phalloidin eingesetzt. Dazu wird Silibinin teilweise mit einem β-Lactam-Antibiotikum kombiniert,[5] das die antidotische Wirkung unterstützen soll (da beide Substanzen die Aufnahme des Toxins in die Leberzellen unspezifisch hemmen[6]). Pharmazeutisch wird das wasserlösliche Dinatriumsalz des Bernsteinsäureesters des Silibinin, das Dinatriumsilibinin-C-2′,3-bis(hydrogensuccinat), eingesetzt, da die Therapie mittels einer intravenösen Verabreichung durchgeführt wird. Der leberschützende Effekt ist auf die zellmembranstabilisierenden Eigenschaften des Silibinins zurückzuführen. Die Aufnahme der Amatoxine in die Leberzellen wird erschwert und ihr enterohepatischer Kreislauf unterbunden. Silibinin greift in die Transportmechanismen der Hepatozyten ein, indem es die Wiederaufnahme der Amatoxine hemmt. Es inhibiert speziell den organischen Anionentransporter OATP1B3 (= SLCO1B3).[7] Ein zweiter Wirkmechanismus ist die Inhibierung der Ausschüttung von TNF-α.[7][8]
Seit der Einführung in die Therapie bei amanitinbedingten Pilzvergiftungen ist bei rechtzeitiger Behandlung die Sterblichkeitsrate auf 5 bis 12 % zurückgegangen, zuvor lag sie bei 20 bis 30 %.
Im Labor konnten auch Erfolge bei der Behandlung von Prostatakrebszellen gezeigt werden, was mit einer Hemmung der CD44 Expression begründet wird.[9]
Untersuchungen zeigten, dass es ähnlich dem Allopurinol die Xanthinoxidase hemmt und somit Hyperurikämie und daraus folgender Gicht entgegenwirken kann.[10]
Als neue, nicht-invasive Behandlungsstrategie gegen Morbus Cushing wird seit einigen Jahren auch Silibinin erforscht.[11][12][13]
Literatur
- K. Letschert, H. Faulstich u. a.: Molecular characterization and inhibition of amanitin uptake into human hepatocytes. In: Toxicological Sciences. Band 91, Nummer 1, Mai 2006, S. 140–149, doi:10.1093/toxsci/kfj141. PMID 16495352.
- R. Agarwal: Cell signaling and regulators of cell cycle as molecular targets for prostate cancer prevention by dietary agents. In: Biochemical Pharmacology. Band 60, Nummer 8, Oktober 2000, S. 1051–1059, PMID 11007941. (Review).
- X. Zi, R. Agarwal: Silibinin decreases prostate-specific antigen with cell growth inhibition via G1 arrest, leading to differentiation of prostate carcinoma cells: implications for prostate cancer intervention. In: PNAS. Band 96, Nummer 13, Juni 1999, S. 7490–7495, PMID 10377442. PMC 22113 (freier Volltext).
- Mathias Riebold et al.: A C-terminal HSP90 inhibitor restores glucocorticoid sensitivity and relieves a mouse allograft model of Cushing disease. In: Nature Medicine, volume 21, S. 276–280 (2015) doi:10.1038/nm.3776
Einzelnachweise
- Eintrag zu SILYBIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- Eintrag zu Silybin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Juni 2014.
- Datenblatt Silibinin bei Sigma-Aldrich, abgerufen am 23. April 2011 (PDF).
- Beipackzettel zum Medikament Silymarin (Mariendistelfrüchte-Trockenextrakt), Kap. Wirkung. Abgerufen am: 6. Januar 2022.
- Fachinformation aus dem Arzneimittel-Kompendium der Schweiz für Legalon® SIL von Max Zeller Söhne – Stand: Juni 2007.
- P. Schleufe, C. Seidel: Knollenblätterpilz-Intoxikation in der Schwangerschaft. In: Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, November 2003, S. 716–718, hier: S. 717.
- U. Mengs, R. T. Pohl, T. Mitchell: Legalon® SIL: the antidote of choice in patients with acute hepatotoxicity from amatoxin poisoning. In: Current Pharmaceutical Biotechnology. Band 13, Nummer 10, August 2012, S. 1964–1970, PMID 22352731. PMC 3414726 (freier Volltext). (Review).
- L. Al-Anati, E. Essid u. a.: Silibinin protects OTA-mediated TNF-alpha release from perfused rat livers and isolated rat Kupffer cells. In: Molecular nutrition & food research. Band 53, Nummer 4, April 2009, S. 460–466, doi:10.1002/mnfr.200800110. PMID 19156713.
- A. M. Handorean, K. Yang, E. W. Robbins, T. W. Flaig, K. A. Iczkowski: Silibinin suppresses CD44 expression in prostate cancer cells. In: American Journal of Translational Research. Band 1, Nummer 1, 2009, S. 80–86, PMID 19966941, PMC 2776293 (freier Volltext).
- J. M. Pauff, R. Hille: Inhibition studies of bovine xanthine oxidase by luteolin, silibinin, quercetin, and curcumin. In: Journal of natural products. Band 72, Nummer 4, April 2009, S. 725–731, doi:10.1021/np8007123, PMID 19388706, PMC 2673521 (freier Volltext).
- Max-Planck-Gesellschaft: Silibinin - pflanzlicher Wirkstoff gegen Hirntumore. 9. Februar 2015.
- Max-Planck-Gesellschaft: IBI lizenziert Silibinin zur Behandlung von Morbus Cushing. 10. Juli 2018
- Silibinin: Neuer Ansatz bei Morbus Cushing? In: Pharmazeutische Zeitung, 12. Juli 2018.