Polyporsäure
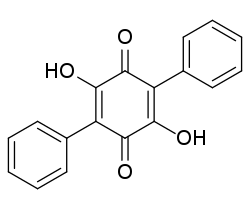
Polyporsäure ist ein Pilzinhaltsstoff und der einfachste Vertreter aus der Stoffklasse der Terphenylchinone. Die Verbindung wurde erstmals 1877 durch Carl Stahlschmidt (1831–1902) beschrieben.[4] Die Struktur der Polyporsäure wurde 1926 von Fritz Kögl aufgeklärt.[5]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Polyporsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C18H12O4 | ||||||||||||
| Kurzbeschreibung |
bronzefarbene Platten[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 292,29 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt |
310–312 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen
Polyporsäure kommt in einigen Baumpilzen der Ordnung Aphyllophorales und in der Laubflechte Sticta coronata vor. Insbesondere beim Zimtfarbenen Weichporling (Hapalopilus rutilans) besteht die Trockenmasse bis zu 43,5 % (nach anderen Angaben zu etwa 20 %[3]) aus Polyporsäure.[1]
Eigenschaften
Aus Pyridin bildet Polyporsäure rote und aus Dioxan gelbe Solvate.[1] In verdünnten Laugen löst sich die Verbindung als Farbstoff mit tiefvioletter Farbe und fällt beim Ansäuern als ockergelber Feststoff aus. Mit konzentrierter Kaliumhydroxidlösung kristallisiert das tiefpurpurne Kaliumsalz.[6]
Polyporsäure ist verantwortlich für Vergiftungserscheinungen, die nach dem Verzehr des Zimtfarbenen Weichporlings mit einer Latenzzeit von etwa 12 Stunden auftreten. Diese sind durch zentralnervöse Störungen (Seh- und Koordinationsstörungen) und Nierenversagen gekennzeichnet.[3] Ein Symptom der Polyporsäure-Vergiftung – auch als Polyporsäure-Syndrom bezeichnet – ist die Violettfärbung des Urins.[7]
Beim Screening von Pflanzenprodukten zeigte sich, dass eine Zubereitung aus polyporsäurehaltigen Flechten die Lebensdauer von Mäusen, die zuvor mit einer akuten lymphatischen Leukämie geimpft worden waren, bedeutsam verlängerte. Als aktive Komponente wurde die Polyporsäure identifiziert. Synthetische Polyporsäure zeigte eine ähnliche antileukämische Wirkung wie die natürliche Zubereitung.[8] Bisher hat diese schon 1959 berichtete antileukämische Wirkung von Polyporsäure oder eventuellen, davon abgeleiteten chemischen Derivaten zu keiner medizinischen Anwendung gefunden.[9]
Polyporsäure sowie verschiedene ihrer 3,6-Derivate verringern die vegetative Vermehrung und die Sporenkeimung von zwölf Pilzarten, die zu sechs verschiedenen Gattungen gehören.[10]
Biosynthese
Die Polyporsäure entsteht bei der Biosynthese durch Dimerisierung von Phenylbrenztraubensäure.[1]
Laborsynthesen
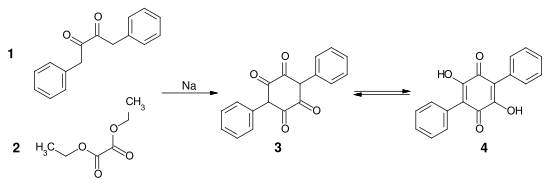
Bei dem Syntheseweg nach Friedrich Fichter[11] wird 1,4-Diphenylbutan-2,3-dion 1 mit Oxalsäurediethylester 2 in Gegenwart von Natrium im Sinne einer doppelten Keto-Claisen-Kondensation umgesetzt. Aus dem primär entstehenden Cyclohexantetron-Derivat 3 erhält man über eine Keto-Enol-Tautomerie die Polyporsäure 4.[12][5]
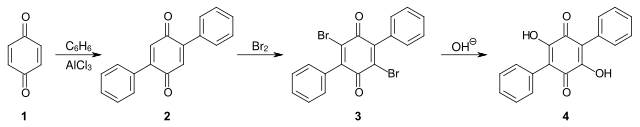
Eine weitere Laborsynthese mit besseren Ausbeuten geht von p-Benzochinon 1 aus. Nach einer von Rudolf Pummerer publizierten Methode wird dieses mit Benzol in Gegenwart von AlCl3 zu dem 2,5-Diphenyl-p-benzochinon 2 umgesetzt.[13] Das Diphenylbenzochinon wird in Eisessig mit Brom zu dem 3,6-Dibrom-2,4-diphenyl-P-benzochinon umgesetzt. Aus der Dibromverbindung erhält man mit einer Natriumhydroxid-Lösung in Methanol bei Raumtemperatur die Polyporsäure 4.[14][15]
Einzelnachweise
- Eintrag zu Polyporsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. September 2019.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- J. Langner, S. Bauer, J. Miersch, F.-W. Rath: Zur biologischen Wirkung der Polyporsäure. Toxikologische und biochemische Bearbeitung von zwei Vergiftungsgeschehen mit dem Zimtfarbenen Weichporling (Hapalopilus rutilans). In: Zeitschrift für Mykologie. Band 58, Nr. 2, 1992, S. 173–184 (dgfm-ev.de [PDF]).
- C. Stahlschmidt: Ueber eine neue in der Natur vorkommende organische Säure. In: Justus Liebig's Annalen der Chemie. Band 187, Nr. 2-3, 1877, S. 177, doi:10.1002/jlac.18771870204.
- Fritz Kögl: Untersuchungen über Pilzfarbstoffe. V. Die Konstitution der Polyporsäure. In: Justus Liebig's Annalen der Chemie. Band 447, Nr. 1, 1926, S. 78, doi:10.1002/jlac.19264470108.
- Jan-Markus Teuscher: Neue experimentelle Designs zum Thema Naturstoffe im Chemieunterricht: Chemie mit Pilzen. Dissertation. Friedrich-Schiller-Universität Jena, Jena 2011, DNB 1017067767, S. 99 (db-thueringen.de [PDF]).
- Vergiftungssyndrome. Polyporsäure-Syndrom, Hapalopilus-Syndrom. Deutsche Gesellschaft für Mykologie e.V., abgerufen am 4. September 2019.
- J. F. Burton, B. F. Cain: Antileukæmic Activity of Polyporic Acid. In: Nature. Band 184, 1959, S. 1326–1327, doi:10.1038/1841326a0.
- M. Gill, W. Steglich: Pigments of Fungi (Macromycetes). In: Fortschritte der Chemie organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products. Springer Science & Business Media, 1987, ISBN 3-7091-6971-2, Kap. 2.1.2 Polyporic acid and derivatives, S. 18 (englisch).
- D. Brewer, W. S. G. Maass, A. Taylor: The effect on fungal growth of some 2,5-dihydroxy-1,4-benzoquinones. In: Canadian Journal of Microbiology. Band 23, 1977, S. 845–851, doi:10.1139/m77-126.
- Fr. Fichter: Ueber synthetische p-dialkylirte Dioxychinone. In: Justus Liebig's Annalen der Chemie. Band 361, Nr. 2-3, 1908, S. 363, doi:10.1002/jlac.19083610209.
- The Complete Book on Natural Dyes & Pigments. Asia Pacific Business Press, Delhi 2005, ISBN 81-7833-032-6, S. 319 (eingeschränkte Vorschau in der Google-Buchsuche).
- Rudolf Pummerer, Ernst Prell: Über die Anlagerung von Benzol an Chinon. In: Berichte der deutschen chemischen Gesellschaft. Band 55, Nr. 9, 14. Oktober 1922, S. 3105, doi:10.1002/cber.19220550920.
- Robert L. Frank, George R. Clark, James N. Coker: The Synthesis of Vulpinic Acid from Polyporic Acid. In: Journal of the American Chemical Society. Band 72, Nr. 4, April 1950, S. 1824, doi:10.1021/ja01160a121.
- P. R. Shildneck, Roger Adams: THE SYNTHESIS OF POLYPORIC ACID AND ATROMENTIN DIMETHYL ETHER. In: Journal of the American Chemical Society. Band 53, Nr. 6, Juni 1931, S. 2373, doi:10.1021/ja01357a053.