Ponatinib
Ponatinib (Handelsname Iclusig; Hersteller Incyte) ist ein Arzneistoff, der in der Behandlung der chronischen myeloischen Leukämie (CML) oder der BCR-ABL-positiven akuten lymphatischen Leukämie (Ph+ALL) eingesetzt wird.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
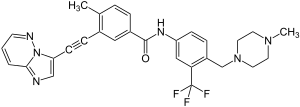 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Ponatinib | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C29H27F3N6O | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
L01XE24 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 532,22 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Wirkungsmechanismus
Ponatinib ist ein Tyrosinkinase-Inhibitor (TKI) mit antiangiogenetischen und antineoplastischen Wirkungen. Die oral anwendbare Substanz hemmt verschiedene Tyrosinkinasen, unter anderem solche aus der ABL-, SRC-, VEGFR- und FGFR -Familie.
Ponatinib ist vor allem deshalb von großem therapeutischen Interesse, weil die Substanz auch bei der BCR-ABL-T315I-Mutation wirksam ist, bei der alle anderen bisher zugelassenen TKI (Imatinib, Nilotinib, Dasatinib, Bosutinib) unwirksam sind. Die Substanz ist in Dosen von 45 mg einmal täglich wirksam.
Entwicklungsgeschichte
Ponatinib wurde von dem Pharmaunternehmen Ariad Pharmaceuticals, zunächst unter der internen Bezeichnung ‚AP24534‘, entwickelt. Der im August 2012 bei der amerikanischen Food and Drug Administration (FDA) gestellte Antrag auf beschleunigte Zulassung[2] wurde im Dezember 2012 positiv entschieden.[3][4] Die Zulassung wurde für die Therapie von Patienten mit chronischer myeloischer Leukämie (CML) oder BCR-ABL-positiver akuter lymphatischer Leukämie (ALL), die resistent gegenüber anderen Tyrosinkinase-Inhibitoren sind, oder bei denen diese aufgrund von Unverträglichkeit nicht verabreicht werden können, erteilt. Grundlage waren vor allem die Ergebnisse der PACE-Studie.[3] Das Arzneimittel kam in den USA unter dem Handelsnamen Iclusig auf den Markt. Im Juli 2013 folgte die Zulassung für die gleichen Anwendungsgebiete durch die EU-Kommission für den europäischen Markt.[5]
Die im November 2013 im New England Journal of Medicine veröffentlichten aktualisierten Ergebnisse der PACE-Studie zeigten bei einer Gruppe von 449 intensiv vorbehandelten Patienten mit CML oder BCR-ABL-positiver ALL, bei denen Nilotinib und Dasatinib entweder nicht vertragen wurde oder unwirksam war oder die die BCR-ABL T315-Mutation trugen, eine insgesamt bemerkenswerte Wirksamkeit. Die Wirkung war allerdings deutlich schlechter bei CML in Blastenkrise und ALL, als bei CML in chronischer Phase. Arteriell-thrombotische Ereignisse wurden bei 9 % der mit Ponatinib behandelten Patienten beobachtet, von denen 3 % auf die Behandlung zurückgeführt wurden.[6]
Im Rahmen der EPIC-Studie (Evaluation of Ponatinib versus Imatinib in Chronic Myeloid Leukemia) wurde die Wirksamkeit von Ponatinib im Vergleich zu Imatinib bei bislang unbehandelten CML-Patienten, d. h. in der first line geprüft.[7] Am 18. Oktober 2013 gab Ariad Pharmaceuticals den vorzeitigen Abbruch dieser Studie bekannt, nachdem es zu einem gehäuften Auftreten von arteriellen Thrombosen bei mit Ponatinib behandelten Patienten gekommen war.[8] Das Unternehmen kündigte an, keine neuen Patienten in laufende klinische Studien einzuschließen, bis in Zusammenarbeit mit der FDA neue Dosierungsempfehlungen (evtl. 30 mg oder 15 mg statt 45 mg) und Sicherheitsmaßnahmen für die Anwendung, wie etwa gleichzeitige Antikoagulanziengabe, erarbeitet worden seien.[9]
Nebenwirkungen
Die häufigsten, bei mehr als 1 % der Behandelten beobachteten Nebenwirkungen, darunter auch schwerwiegende, waren Hautveränderungen (Hautausschlag, Trockenheit), Bauchschmerzen, Fieber, Anämie, Veränderungen im Blutbild (Neutropenie, Thrombozytopenie, Panzytopenie), Bauchspeicheldrüsenentzündung (Pankreatitis), Herzinfarkt, Durchfall und erhöhte Lipasewerte.[10]
In der langfristigen Nachverfolgung von Patienten in laufenden Phase-1- und Phase-2-Studien wurde eine Zunahme von arteriellen (kardiovaskulären, zerebrovaskulären und peripheren vaskulären) und venösen thrombotischen Ereignissen beobachtet, was im Dezember 2013 zur Einführung entsprechender Anwendungsbeschränkungen und Sicherheitsmaßnahmen für Patienten mit kardiovaskulären Risikofaktoren führte.[11]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Dave Levitan: Accelerated FDA Approval for CML Drug Ponatinib Sought. CancerNetwork, 9. August 2012, abgerufen am 25. Dezember 2012 (englisch).
- Ponatinib. 17. Dezember 2012, abgerufen am 25. Dezember 2012 (englisch).
- Jorge E. Cortes, Hagop Kantarjian, Neil P. Shah, Dale Bixby, Michael J. Mauro, Ian Flinn, Thomas O’Hare, Simin Hu, Narayana I. Narasimhan, Victor M. Rivera, Tim Clackson, Christopher D. Turner, Frank G. Haluska, Brian J. Druker, Michael W. N. Deininger, Moshe Talpaz: Ponatinib in refractory Philadelphia chromosome-positive leukemias. In: The New England Journal of Medicine. Band 367, Nr. 22, 29. November 2012, S. 2075–2088, doi:10.1056/NEJMoa1205127, PMID 23190221.
- ARIAD meldet Zulassung von Iclusig® (Ponatinib) in der Europäischen Union. PharmaZeitung.de, 2. Juli 2013, abgerufen am 4. Juli 2013.
- J. E. Cortes, D.-W. Kim, J. Pinilla-Ibarz, P. le Coutre, R. Paquette, C. Chuah, F. E. Nicolini, J. F. Apperley, H. J. Khoury, M. Talpaz, J. DiPersio, D. J. DeAngelo, E. Abruzzese, D. Rea, M. Baccarani, M. C. Müller, C. Gambacorti-Passerini, S. Wong, S. Lustgarten, V. M. Rivera, T. Clackson, C. D. Turner, F. G. Haluska, F. Guilhot, M. W. Deininger, A. Hochhaus, T. Hughes, J. M. Goldman, N. P. Shah, H. Kantarjian, PACE Investigators: A phase 2 trial of ponatinib in Philadelphia chromosome-positive leukemias. In: The New England Journal of Medicine. Band 369, Nr. 19, 7. November 2013, S. 1783–1796, doi:10.1056/NEJMoa1306494, PMID 24180494.
- Ponatinib in Newly Diagnosed Chronic Myeloid Leukemia (CML) (EPIC). clinicaltrials.gov, abgerufen am 15. Januar 2013 (englisch).
- ARIAD Announces Discontinuation of the Phase 3 Epic Trial of Iclusig in Patients with Newly Diagnosed Chronic Myeloid Leukemia. Abgerufen am 21. Oktober 2013 (englisch).
- ARIAD Announces Changes in the Clinical Development Program of Iclusig. In: ARIAD Pharmaceuticals. 8. Oktober 2013, abgerufen am 21. Oktober 2013 (englisch).
- Produktinformation zu Iclusig (PDF; 639 kB) der europäischen Arzneimittelagentur (EMA).
- Rote Hand Brief von ARIAD Pharmaceuticals GmbH im Dezember 2013. (PDF; 78 kB) Abgerufen am 3. Dezember 2013.