B-Zell-Rezeptor
Der B-Zell-Rezeptor (englisch B-cell receptor, BCR) ist ein Transmembranprotein und Rezeptor auf B-Zellen, an den ein Antikörper gebunden ist. Der BCR ist ein zentraler Bestandteil der humoralen Immunantwort.
Eigenschaften
Nach der spezifischen Bindung eines Antigens durch den Antikörper am BCR werden B-Zellen aktiviert und sind, wenn sie durch Zytokine der T-Zellen angeregt werden, zur Zellteilung und zur Zelldifferenzierung in B-Gedächtniszellen und B-Plasmazellen bereit. Der BCR besitzt zwei Funktionen, eine zur Signaltransduktion und eine zur Endozytose und zur Einleitung der Antigenpräsentation von Peptiden an MHC-2. Defekte im BCR führen zu einer Beeinträchtigung der Produktion von Antikörpern und der Signaltransduktion, welche in einer Immundefizienz, Autoimmunität oder Malignität resultiert.[1][2][3]
Aufbau
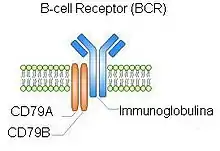
Der B-Zell-Rezeptor besteht aus einer Ligandenbindungsfunktion (in Folge auch aus einer Oligomerisierungsfunktion) und einer Signaltransduktionsfunktion.[4] Die Ligandenbindung erfolgt durch den gebundenen Antikörper (IgD, IgM, IgA oder IgE) und führt zu den Funktionen der Oligomerisierung, der Opsonisierung, der Komplementaktivierung und der Neutralisation. Die Signaltransduktion erfolgt über das Heterodimer CD79 A und B, deren Bestandteile A und B über Disulfidbrücken verbunden sind. Durch Bindung eines Korezeptor-Proteinkomplexes aus CD19, CD21 (synonym CR2) und CD81 (synonym TAPA-1) wird die Signaltransduktion um etwa den Faktor 100 verstärkt. Dadurch kann auch eine Komplementaktivierung zu einer Aktivierung des BCR führen. CD79 A und B sind Transmembranproteine mit ITAM-Motiven auf der zytosolischen Seite zur intrazellulären Signalweiterleitung.
Signaltransduktion
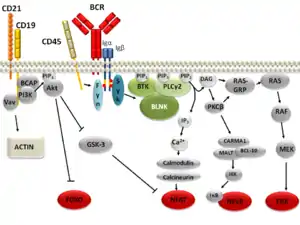
Bindet der B-Zell Rezeptor ein passendes Antigen, so werden die ITAM Motive von Tyrosinkinasen der SRC Family, unter anderem LYN, FYN und BLK, phosphoryliert. An die phosphorylierten Tyrosinreste kann die Tyrosinkinase Syk binden, die wiederum das Gerüstprotein BLNK an mehreren Stellen phosphoryliert. BLNK kann nun weitere Signalproteine binde, die das Signal in den Zellkern weiterleiten.[5] Die Weiterleitung des Signal erfolgt über Phospholipase Cγ (PLC-γ) und NFAT, über die PI3K, über die IKK und NF-κB, sowie über die ERK.[6] Die Signaltransduktion ist weiterhin durch nichtkodierende Ribonukleinsäuren beeinflusst.[7] Über die IKK und NF-κB wird durch CD79 und andere Proteine die PLC-γ aktiviert, anschließend bindet die PLC-γ an c-SMAC und hydrolysiert PIP2 zu IP3 und Diacylglycerol, zwei sekundären Botenstoffen.[6]
Verschiedene Mutationen des B-Zell-Rezeptors sind an der Entstehung von B-Zell-Tumoren beteiligt.[7] Möglicherweise liegt dies an einer Daueraktivierung des BCR,[8] oder an Unterschieden in der Oligomerisierung.[9][10][11][12]
Literatur
Weblinks
Einzelnachweise
- Mary Ellen Conley, A. Kerry Dobbs, Dana M. Farmer, Sebnem Kilic, Kenneth Paris, Sofia Grigoriadou, Elaine Coustan-Smith, Vanessa Howard, and Dario Campana: Primary B cell immunodeficiencies: comparisons and contrasts. In: Annual Review of Immunology. 27, 2009. doi:10.1146/annurev.immunol.021908.132649.
- Christopher Goodnow: Multistep pathogenesis of autoimmune disease. In: Cell. 130, Nr. 1, 2007, S. 25–35. doi:10.1016/j.cell.2007.06.033. PMID 17632054.
- D Corcos, M.J. Osborn, L.S. Matheson: B-cell receptors and heavy chain diseases: guilty by association?. In: Blood. 117, Nr. 26, 2011, S. 6991–6998. doi:10.1182/blood-2011-02-336164. PMID 21508409.
- Kindt, J. Thomas; Goldsby, A. Richard; Osborne, A. Barbara, Janis Kuby: Kuby immunology. W.H. Freeman, New York 2007, ISBN 1-4292-0211-4.
- Janeway's immunobiology, 8th. Auflage, Garland Science, 2011, ISBN 0815342438, S. 258–260.
- Tomohiro Kurosaki, Hisaaki Shinohara, Yoshihiro Baba: B Cell Signaling and Fate Decision. In: Annual Review of Immunology. 28, Nr. 1, 2008, S. 21. doi:10.1146/annurev.immunol.021908.132541.
- M. Mraz, T. J. Kipps: MicroRNAs and B cell receptor signaling in chronic lymphocytic leukemia. In: Leukemia & Lymphoma. Band 54, Nummer 8, August 2013, ISSN 1029-2403, S. 1836–1839, doi:10.3109/10428194.2013.796055, PMID 23597135.
- W. Daneshek, R.S. Schwartz: Leukemia and auto-immunization- some possible relationships. In: Blood. 14, 1959.
- D. Corcos: Oncogenic potential of the B-cell antigen receptor and its relevance to heavy chain diseases and other B-cell neoplasias: a new model. In: Research in immunology. Band 141, Nummer 6, 1990 Jul-Aug, ISSN 0923-2494, S. 543–553, PMID 2284498.
- D. Corcos, O. Dunda, C. Butor, J. Y. Cesbron, P. Lorès, D. Bucchini, J. Jami: Pre-B-cell development in the absence of lambda 5 in transgenic mice expressing a heavy-chain disease protein. In: Current biology : CB. Band 5, Nummer 10, Oktober 1995, ISSN 0960-9822, S. 1140–1148, PMID 8548286.
- R. E. Davis, V. N. Ngo, et al.: Chronic active B-cell-receptor signalling in diffuse large B-cell lymphoma. In: Nature. Band 463, Nummer 7277, Januar 2010, ISSN 1476-4687, S. 88–92, doi:10.1038/nature08638. PMID 20054396, PMC 2845535 (freier Volltext) .
- M. Dühren-von Minden, R. Übelhart, D. Schneider, T. Wossning, M. P. Bach, M. Buchner, D. Hofmann, E. Surova, M. Follo, F. Köhler, H. Wardemann, K. Zirlik, H. Veelken, H. Jumaa: Chronic lymphocytic leukaemia is driven by antigen-independent cell-autonomous signalling. In: Nature. Band 489, Nummer 7415, September 2012, ISSN 1476-4687, S. 309–312, doi:10.1038/nature11309. PMID 22885698.