Nilotinib
Nilotinib (Handelsname: Tasigna®, Hersteller: Novartis) ist ein Proteinkinaseinhibitor, der unter der Bezeichnung AMN107 entwickelt wurde. Er ist ein spezifischer BCR-ABL-Tyrosinkinase-Inhibitor. Tasigna wurde erstmals Mitte 2007 in der Schweiz für die Behandlung der chronischen myeloischen Leukämie (CML) zugelassen, kurze Zeit später folgte die Zulassung in den USA und der EU. Seit dem 1. Januar 2008 ist das verschreibungspflichtige Arzneimittel in Deutschland zur Behandlung der CML erhältlich.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
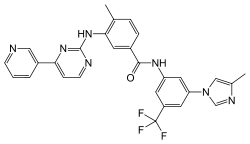 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Nilotinib | |||||||||||||||||||||
| Andere Namen |
4-Methyl-N-[3-(4-methylimidazol-1-yl)-5-(trifluormethyl)phenyl]-3-[(4-pyridin-3-ylpyrimidin-2-yl)amino]benzamid (IUPAC) | |||||||||||||||||||||
| Summenformel | C28H22F3N7O | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE08 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 529,52 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Die Zulassung erfolgte zunächst für Patienten, die eine Behandlung mit Imatinib nicht tolerieren oder nicht darauf ansprechen. Ende 2010 folgte die Zulassung auch für neu diagnostizierte Patienten. Grundlage der Zulassung waren große Phase-III-Therapiestudien, in denen Nilotinib auch bei Imatinib-resistenten CML-Patienten Wirksamkeit gezeigt hatte.[2]
Derzeit (Stand Juli 2020) befindet sich Nilotinib in einer Phase-II-Studie zur Behandlung der Alzheimer-Krankheit.[3][4]
Nebenwirkungen
Nilotinib kann wie die meisten Tyrosinkinaseinhibitoren eine reversible Verminderung der roten Blutzellen (Anämie), weißen Blutzellen (Leukopenie) und Thrombozyten (Thrombozytopenie) verursachen, die in der Regel aber nur gering bis mäßig ausgeprägt ist und den Einsatz des Medikaments nicht limitiert. Nilotinib bedingt in rund 1 % der Patienten Verlängerungen der QT-Zeit im Elektrokardiogramm (EKG). Aufgrund des Auftretens des plötzlichen Herztodes bei 0,6 % der Patienten in der Phase-II-Zulassungsstudie für Nilotinib gelten Kalium- oder Magnesiummangel oder ein Long-QT-Syndrom als Gegenanzeigen zu einer Behandlung mit Nilotinib. Da Nilotinib bei gleichzeitiger Einnahme mit Fett zu kurzfristig deutlich erhöhten Plasmaspiegeln führen kann, sollte zwei Stunden vor und eine Stunde nach Einnahme des Präparats keine Nahrung eingenommen werden. Ebenso sollten EKG-Kontrollen vor Therapiebeginn und im Verlauf vorgenommen werden.[5]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- H. Kantarjian et al.: Nilotinib in Imatinib-Resistant CML and Philadelphia Chromosome–Positive ALL. In: New England Journal of Medicine. Band 354, Nr. 24, 15. Juni 2006, S. 2542–2551, doi:10.1056/NEJMoa055104, PMID 16775235.
- Sven Siebenand: Demenz-Forschung: Nilotinib bei Morbus Alzheimer im Gespräch. In: pharmazeutische-zeitung.de. 20. Juli 2020, abgerufen am 20. Juli 2020.
- Klinische Studie (Phase II): Impact of Nilotinib on Safety, Biomarkers and Clinical Outcomes in Mild to Moderate Alzheimer's Disease (AD) bei Clinicaltrials.gov der NIH
- E. Jabbour, M. Deininger, A. Hochhaus: Management of adverse events associated with tyrosine kinase inhibitors in the treatment of chronic myeloid leukemia. In: Leukemia. Band 25, Nr. 2, 2011, S. 201–210, doi:10.1038/leu.2010.215, PMID 20861918.
Weblinks
- Nilotinib in der EU zugelassen, Leukämie-Online vom 28. November 2007
- Europäischer öffentlicher Beurteilungsbericht (EPAR) und Produktinformation zu Tasigna auf der Website der Europäischen Arzneimittelagentur