Bosutinib
Bosutinib (Firma Pfizer), zuvor als SKI-606 bezeichnet, ist ein Arzneistoff aus der Substanzklasse der Tyrosinkinase-Inhibitoren.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
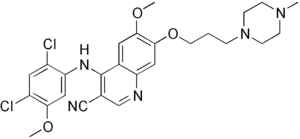 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Bosutinib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C26H29Cl2N5O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE14 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 530,45 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Bosutinib hemmt beim Menschen verschiedene Tyrosinkinasen, vor allem aus der Abl- und Src-Familie. Am 4. September 2012 wurde Bosutinib durch die amerikanische Food and Drug Administration (FDA) zur Behandlung von Patienten mit chronischer myeloischer Leukämie (CML), bei denen andere Tyrosinkinase-Inhibitoren (z. B. Imatinib) unwirksam sind oder nicht vertragen werden, zugelassen.[3] Bosutinib ist als Arzneimittel unter dem Namen Bosulif in den USA im Handel. Die übliche Dosierung sind 500 mg einmal täglich. Grundlage der Zulassung waren vor allem die Ergebnisse der BELA-Studie, die eine vergleichbare Wirksamkeit von Bosutinib und Imatinib gezeigt hatte.[4] Am 27. März 2013 wurde Bosutinib durch die Europäische Kommission zur Behandlung von Patienten mit CML, die mindestens schon einen Tyrosinkinaseinhibitor bekommen haben und bei denen Imatinib, Nilotinib und Dasatinib durch den behandelnden Arzt als nicht sinnvoll erachtet werden, zugelassen. Die Zulassung erfolgte unter der Auflage, dass von Seiten des pharmazeutischen Unternehmers noch weitere Nachweise über den Nutzen des Medikaments beizubringen sind. Außerdem sollen jährliche Evaluationen durch die europäische Arzneimittelagentur stattfinden.[5]
Die Eigenschaft als Src-Kinase-Inhibitor macht Bosutinib zu einem potenziellen Therapeutikum für die Behandlung von Brustkrebs. Bei Brustkrebs ist – wie bei vielen anderen Tumoren beim Menschen auch – die Aktivität der Src-Kinasen im Tumorgewebe deutlich erhöht.[6] Gleiches gilt für das kolorektale Karzinom (Darmkrebs).[7]
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Nach einer Erweiterung des Anwendungsgebiets und der Aufhebung des Orphan-Drug-Status durchlief Bosutinib 2018 zwei frühe Nutzenbewertungen. Zunächst wurde es im neuen Anwendungsgebiet (Behandlung Erwachsener mit neu diagnostizierter Philadelphia-Chromosom-positiver chronischer myeloischer Leukämie in der chronischen Phase) mit Imatinib oder Nilotinib oder Dasatinib verglichen.[8] Gemäß G-BA-Beschluss ist ein Zusatznutzen gegenüber dieser zweckmäßigen Vergleichstherapie in der Erstlinie nicht belegt.[9]
Durch Überschreiten der Umsatzgrenze für die vereinfachte Nutzenbewertung für Orphan Drugs, bei der 2013 ein Zusatznutzen zunächst als gegeben vorausgesetzt worden war, wurde nun auch im ursprünglichen Anwendungsgebiet (Erwachsene mit Ph+ CML in der chronischen Phase, akzelerierten Phase und Blastenkrise, die mit mindestens einem Tyrosinkinaseinhibitor vorbehandelt wurden und bei denen Imatinib, Nilotinib und Dasatinib nicht als geeignete Behandlungsoption angesehen werden) eine reguläre frühe Nutzenbewertung durchgeführt.[10] Gemäß G-BA-Beschluss ist auch für diese Patientengruppe ein Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie Ponatinib nicht belegt.[11]
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Bosutinib
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 4-[(2,4-dichloro-5-methoxyphenyl)amino]-6-methoxy-7-[3-(4-methylpiperazin-1-yl)propoxy]quinoline-3-carbonitrile im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. Dezember 2019.
- Datenblatt Bosutinib bei Sigma-Aldrich, abgerufen am 16. Februar 2020 (PDF).
- FDA approves new orphan drug for chronic myelogenous leukemia. FDA, 4. September 2012, abgerufen am 25. Dezember 2012 (englisch).
- Cortes JE, Kim DW, Kantarjian HM, Brümmendorf TH, Dyagil I, Griskevicius L, Malhotra H, Powell C, Gogat K, Countouriotis AM, Gambacorti-Passerini C: Bosutinib Versus Imatinib in Newly Diagnosed Chronic-Phase Chronic Myeloid Leukemia: Results From the BELA Trial. Journal of Clinical Oncology 2012;30:3486-3492 PMID 22949154.
- Anhang 1: Zusammenfassung und Merkmale des Arzneimittels. (PDF; 520 kB) EMA, abgerufen am 29. Mai 2013.
- A. Vultur u. a.: SKI-606 (bosutinib), a novel Src kinase inhibitor, suppresses migration and invasion of human breast cancer cells. Mol. Cancer. Ther. (2008) 7(5): S. 1185–1194, PMID 18483306.
- A. M. Coluccia u. a.: SKI-606 decreases growth and motility of colorectal cancer cells by preventing pp60(c-Src)-dependent tyrosine phosphorylation of beta-catenin and its nuclear signaling. In: Cancer Res., 2006, 66, S. 2279–2286, PMID 18483306.
- A18-33 Bosutinib (chronische myeloische Leukämie) - Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 26. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Bosutinib (neues Anwendungsgebiet: Chronische myeloische Leukämie, Ph+, Erstlinie). g-ba.de; abgerufen am 26. März 2020.
- A18-54 Bosutinib (vorbehandelte chronische myeloische Leukämie) - Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 26. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Bosutinib (Bewertung nach Aufhebung des Orphan-Drug-Status: Chronische myeloische Leukämie, Ph+). g-ba.de; abgerufen am 26. März 2020.