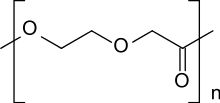
Poly-p-dioxanon
Poly-p-dioxanon (Poly-1,4-dioxan-2-on) – oft als PDS, PPDX oder PPDO abgekürzt – ist ein Poly (ether-ester), der quasi ein alternierendes Copolymer aus Ethylenglycol und Glycolsäure darstellt und durch ringöffnende Polymerisation aus 1,4-Dioxan-2-on entsteht.
Neben dem Homopolymeren ist eine Reihe von statistischen Copolymeren und Blockcopolymeren,[1][2] meist mit anderen Lactonmonomeren, wie Glycolid,[3] Lactid[4] oder ε-Caprolacton[5] beschrieben.
Poly-1,4-dioxan-2-on wurde unter dem Namen PDSTM (polydioxanon sutures) in Form von Monofilamenten als erstes absorbierbares, d. h. biologisch abbaubares, chirurgisches Nahtmaterial im Jahr 1981 eingeführt.[6]
Synthese
Die Herstellung des homopolymeren Poly-p-dioxanons erfolgt in Substanz oder Lösung bei erhöhten Temperaturen (100 °C bis 175 °C) für 3 bis 48 Stunden bei Normaldruck oder Vakuum in Gegenwart von Zinn-Alkoxiden, wie z. B. Dibutylzinndilaurat,[7] Zinn(II)-2-ethylhexanoat[8] oder dem cyclischen Alkoxid 1-Di-n-butyl-1-stanna-2,5-dioxacyclopentan[9], das Umesterungsreaktionen unterdrückt und zu höheren intrinsischen Viskositäten, also Molmassen des Polymers, führen soll.

Die ringöffnende Polymerisation (ROP) des p-Dioxanons mit Aluminiumalkoxiden, wie z. B. Aluminiumisopropoxid[10] oder Aluminium-sec-butoxid führt ebenso zu hochmolekularem PPDO wie mit Diethylzink[11] oder Zirkonylacetylacetonat[11] als Katalysator.
Voraussetzungen für die Erzielung von höhermolekularen Poly-p-dioxanonen ist neben der hohen Reinheit des Monomeren 1,4-Dioxan-2-on (>99,9 %) die Abwesenheit von Wasser, Feuchtigkeit und hydroxygruppenhaltigen Verbindungen, sowie die Anwendung moderater Polymerisationstemperaturen unter 110 °C, d. h. unterhalb der Erstarrungstemperatur von PPDO.[10] Unter diesen Bedingungen reagiert das feste Monomer offensichtlich sehr rasch (innerhalb weniger als 30 Minuten) in den amorphen Bereichen mit der aktiven Aluminium-alkoxidfunktion am Kettenende zu höhermolekularem PPDO.
Während bei der ringöffnenden Polymerisation ähnlicher Verbindungen, wie z. B. ε-Caprolacton vollständiger Monomerumsatz erzielt werden kann, liegen die Polymerausbeuten bei p-Dioxanon – auch bei alternativen Verfahren, wie z. B. der Wärmezufuhr durch Mikrowellenstrahlung[12] – in der Regel unter 70 %.
Wegen seiner niedrigen Ceiling-Temperatur von 235 °C (berechnet)[10] bzw. 265 °C (gemessen)[13] ist Poly-p-dioxanon inhärent thermisch instabil und neigt beim Erhitzen, also bei der Bildung als auch bei einer späteren thermischen Umformung durch z. B. Extrusion oder Spritzgießen, zur Depolymerisation mit Kettenabbau vom Hydroxykettenende her (unzipping) unter Bildung des monomeren p-Dioxanons.

Die Depolymerisation wird durch Endcapping, d. h. Verschluss der aktiven Kettenenden gegen Ende der Polymerisation z. B. mit Pyromellitsäuredianhydrid,[8] durch Umsetzung mit Kettenverlängerern (chain extenders)[14] oder durch Copolymerisation mit ähnlichen Lactonen, wie z. B. ε-Caprolacton.[15] unterdrückt.
Die reaktive Koextrusion z. B. in einem Doppelschneckenextruder erzeugt bereits bei niedrigen Caprolactongehalten und kurzen Reaktionszeiten unter vollständiger Umsetzung des p-Dioxanons semikristalline Copolymere mit statistisch verteilten, kurzen PPDO- und Polycaprolacton-Blöcken, deren thermische Stabilität bei Schmelzpunkten bis 94 °C gegenüber dem Homopolymer wesentlich verbessert ist. Der effiziente, einstufige, kontinuierliche und schnelle Prozess der reaktiven Koextrusion könnte geeignet sein, die Schwächen des herkömmlichen erzeugten Poly-p-dioxanons zu vermeiden und kommerzielle Mengen reproduzierbar und kostengünstig zu erzeugen.[16]
Eigenschaften
Poly-1,4-dioxan-2-on ist ein semikristallines Polymer (Kristallinität von 37 bis 55 %) mit einem Schmelzpunkt Tm = 110 °C und einer Glasübergangstemperatur Tg = −10 °C.[15] bzw. −16 °C,[11] sowie einem Zahlenmittel der Molmasse Mn von ca. 28000[8] bis ca. 68000[15] und einer relativ engen Polydispersität von ca. 1,6. Das Elastizitätsmodul und die Glasübergangstemperatur von PPDO ist im Vergleich zu den Polylactonen Polyglycolid und Polylactid niedriger; aufgrund der Etherfunktion im Polymerrückgrat ist PPDO flexibler und weicher als die beiden anderen Polylactone und kann daher auch als Monofilament eingesetzt werden.[11] Poly-p-dioxanon ist zäher als Polylactid und sogar als Polyethylen mit einer Zugfestigkeit von 48,3 MPa bei einer maximalen Bruchdehnung von 500 bis 700 %.[10]
Zum Einsatz als Implantatmaterial kann Poly-1,4-dioxan-2-on ohne wesentliche Verschlechterung der mechanischen Eigenschaften strahlensterilisiert werden.[11]
Unter physiologischen Bedingungen wird PPDO chemisch abgebaut, wobei nach vier Wochen noch ca. 58 % der ursprünglichen Nahtstärke vorhanden war. Nach ca. 180 Tagen im Körper ist das Polymer ohne negative Gewebereaktionen vollständig abgebaut.
Segmentierte Copolymere oder Blockcopolymere von PPDO mit anderen Lactonen führen zu Materialien mit geänderten Eigenschaftsprofilen, wie z. B. kürzerer Abbaudauer in vivo bei Polyglycolid- oder höherer Flexibilität bei Poly-ε-Caprolacton-Segmenten.
Anwendungen
Die für Poly-p-dioxanon diskutierten und realisierten Anwendungen umfassen bioabbaubare Folien, Fasern, Vliese, Klebstoffe und Beschichtungen, insbesondere aber biokompatible Artikel zur Wundversorgung wie resorbierbares chirurgisches Nahtmaterial (PDS), Ligaturclips, Wundklammern, Nadeln und Knochenstifte, wie z. B. Ethipin.[17]
Während das Homopolymer Poly-p-dioxanon keine Anwendungen als Implantatmaterial für die kontrollierte Wirkstofffreisetzung im Körper gefunden hat, scheinen Copolymere, wie z. B. aus 1,4-Dioxan-2-on und ω-Pentadecalacton (Cyclopentadecanolid) dafür geeignet zu sein.[18]
.svg.png.webp)
Einzelnachweise
- R.S. Bezwada, D.D. Jamiolkowski, K. Cooper: Poly(p-dioxane) and its copolymers, in Handbook of Biodegradable Polymers. Hrsg.: A.J. Domb, J. Kost, D.M. Wiseman. Harwood Academic Publishers, 1997, ISBN 90-5702-153-6, Kap. 2, S. 29–61.
- K.-K. Yang, X.-L. Wang, Y.-Z. Wang: Poly(p-dioxanone) and its copolymers. In: J. Macromol. Sci., Part C Polym. Rev. Band 42, Nr. 3, 2002, S. 373–398, doi:10.1081/MC-120006453.
- Patent US4653497: Crystalline p-dioxanone/glycolide copolymers and surgical devices made therefrom. Angemeldet am 29. November 1985, veröffentlicht am 31. März 1987, Anmelder: Ethicon, Inc., Erfinder: R.S. Bezwada, S.W. Shalaby, H.D. Newman, Jr..
- Patent US4643191: Crystalline copolymers of p-dioxanone and lactide and surgical devices made therefrom. Angemeldet am 29. November 1985, veröffentlicht am 17. Februar 1987, Anmelder: Ethicon, Inc., Erfinder: R.S. Bezwada, S.W. Shalaby, H. Newman, Jr., A. Kafrawy.
- Patent US5047048: Crystalline copolymers of p-dioxanone and ε-caprolactone. Angemeldet am 29. November 1985, veröffentlicht am 17. Februar 1987, Anmelder: Ethicon, Inc., Erfinder: R.S. Bezwada, S.W. Shalaby, M. Erneta.
- J.A. Ray, N. Doddi, D. Regula, J.A. Williams, A. Melveger: Polydioxanone (PDS), a novel monofilament synthetic absorbable suture. In: Surgery, Gynecology & Obstetrics. Band 151, Nr. 4, 1981, S. 497–507, PMID 6792722.
- Patent US3645941: Method of preparing 2-p-dioxanone polymers. Angemeldet am 1. April 1970, veröffentlicht am 29. Februar 1972, Anmelder: Eastman Kodak Co., Erfinder: T.C. Snapp, A.E. Blood.
- Patent US5652331: Method for preparing poly-p-dioxanone polymer. Angemeldet am 30. August 1996, veröffentlicht am 29. Juli 1997, Anmelder: Shell Oil Co., Erfinder: T.C. Forschner, D.E. Gwyn, C.A. Veith.
- T. Redin, A. Finne-Wistrand, T. Mathisen, A.-C. Albertsson: Bulk polymerization of p-dioxanone using a cyclic tin alkoxide as initiator. In: J. Polym. Sci., Part A. Band 45, Nr. 23, 2007, S. 5552–5558, doi:10.1002/pola.22301.
- J.-M. Raquez, Ph. Degée, Ph. Dubois: ROP of 1,4-dioxan-2-one initiated by Al(OiPr)3 in bulk: thermodynamics, kinetics and mechanism. (umh.ac.be [PDF]). umh.ac.be (Memento des Originals vom 4. März 2016 im Internet Archive; PDF) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Patent US4032988: Synthetic absorbable surgical devices of poly-dioxanone. Angemeldet am 12. Juni 1976, veröffentlicht am 11. Oktober 1977, Anmelder: Ethicon, Inc., Erfinder: N. Doddi, C.C. Versfelt, D. Wasserman.
- Y. Li, X.-L. Wang, K.-K. Yang, Y.-Z. Wang: A rapid synthesis of poly (p-dioxanone) by ring-opening polymerization under microwave irradiation. In: Polym. Bull. Band 57, Nr. 6, 2006, S. 873–880, doi:10.1007/s00289-006-0668-2.
- H. Nishida, M. Yamashita, T. Endo, Y. Tokiwa: Equilibrium polymerization behavior of 1,4-dioxan-2-one in bulk. In: Macromolecules. Band 33, Nr. 19, 2000, S. 6982–6986, doi:10.1021/ma000457t.
- X.-L. Wang, S.-C. Chen, Y.-H. Zhang, K.-K. Yang, Y.-Z. Wang: A biodegradable copolymer from coupling poly(p-dioxanone) with poly(ethylene succinate) via toluene-2,4-diisocyanate. In: e-Polymers. Band 9, 2009, S. 133–144, doi:10.1515/epoly.2009.9.1.133.
- J.-M. Raquez, P. Degée, P. Dubois, S. Balakrishnan, R. Narayan: Melt-stable poly(1,4-dioxan-2-one) (co)polymers by ring-opening polymerization via continuous reactive extrusion. In: Polym. Eng. Sci. Band 45, Nr. 4, 2005, S. 622–629, doi:10.1002/pen.20312.
- Patent WO2006020544: Copolymerization of 1,4-dioxan-2-one and a cyclic ester monomer producing thermal stabilized 1,4-dioxan-2-one (co)polymers. Angemeldet am 8. August 2005, veröffentlicht am 23. Februar 2006, Anmelder: Michigan State University, Erfinder: R. Narayan, J.-M. Raquez, S. Balakrishnan, P. Dubois, P. Degee.
- J.-M. Raquez, O. Coulombier, A. Duda, R. Narayan, P. Dubois: Recent advances in the synthesis and applications of poly(1,4-dioxan-2-one) based copolymers. In: Polymery. Band 53, Nr. 3, 2009, S. 165–178.
- J. Liu, Z. Jiang, C. Liu, R.A. Gross, T.R. Kyriakides, W.M. Saltzman: Biodegradation, biocompatibility, and drug delivery in poly(ω-pentadecalactone-co-p-dioxanone) copolyesters. In: Biomaterials. Band 32, Nr. 27, 2011, S. 6646–6654, doi:10.1016/j.biomaterials.2011.05.046.