Glycolid
Glycolid ist der dimere cyclische Ester der Glycolsäure (Hydroxyessigsäure), die wegen des geringen Abstands von Hydroxy- und Carboxygruppe kein Lacton bilden kann. Der dimere lineare Ester der Glycolsäure stellt eine 5-Hydroxycarbonsäure dar, die weiter zu niedrigmolekularen Glycolsäureoligomeren polymerisiert.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
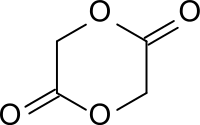 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glycolid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H4O4 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Durch thermische Depolymerisation wird daraus die sechsgliedrige Ringstruktur des Glycolids gebildet. Die ringöffnende Polymerisation erzeugt aus Glycolid Polyglycolid (Polyglycolsäure PGA) mit Molmassen Mw>50,000, das als bioabbaubares Implantatmaterial[6] und in industriellen Anwendungen z. B. als Barrierefolie mit verminderter Sauerstoff- und Kohlendioxiddurchlässigkeit für Polyethylenterephthalat-Getränke- und Lebensmittelverpackungen Verwendung findet.[7]
Gewinnung und Darstellung
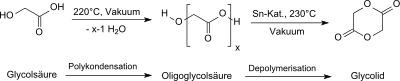
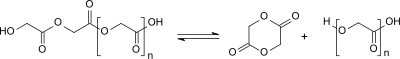
Die Herstellung von Glycolid durch Erhitzen von Glycolsäure im Vakuum wurde erstmals 1860 beschrieben.[8][9] Formal reagieren zwei Moleküle Glycolsäure unter Wasserabspaltung zum Monoester, der unter weiterer Wasserabspaltung zum Glycolid cyclisiert. Tatsächlich entsteht beim Erhitzen oligomere Polyglycolsäure (Mw<30,000), aus der durch Depolymerisation vom Hydroxygruppenende her Glycolid gebildet wird.
Beim trockenen Erhitzen von Alkalisalzen von Halogenessigsäuren unter Stickstoff im Vakuum auf Temperaturen von 250 °C bis 300 °C entsteht Glycolid in bescheidenen Ausbeuten von ca. 20 %.[10]
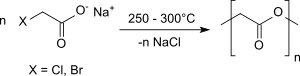
In Gegenwart von Kupferspänen zur besseren Temperaturübertragung im festen Gemisch werden hingegen Ausbeuten bis 72 % erzielt.[11]
Als auch im industriellen Maßstab brauchbares Verfahren zur Herstellung von Glycolid hat sich die thermische Depolymerisation der durch Polykondensation von Glycolsäure erhaltenen oligomeren Polyglycolsäure in Gegenwart von Zinnverbindungen als Umesterungskatalysatoren etabliert. Dabei stellt sich ein Gleichgewicht zwischen ringförmigem Glycolid und kettenförmiger Oligoglycolsäure ein, aus dem Glycolid durch Vakuumdestillation kontinuierlich entfernt wird.
Dazu wird die handelsübliche 70%ige wässrige Glycolsäurelösung zunächst bei Normaldruck und anschließend unter Vakuum auf 220 °C erhitzt. Die erhaltene Oligoglycolsäure wird in hochsiedenden polaren Lösungsmitteln, wie z. B. Oligoethylenglycoldiethern gelöst und mit Zinn-Katalysatoren unter Vakuum auf 230 °C erhitzt, so dass Glycolid zusammen mit dem Lösungsmittel abdestilliert und in hoher Reinheit und Ausbeute beim Abkühlen auskristallisiert.[12]
Eigenschaften
Reines 1,4-Dioxan-2,5-dion ist ein weißer kristalliner Feststoff, der in Blättchen kristallisiert und bei 86 bis 87 °C[2] schmilzt. Durch Kombination von mehrfacher Umkristallisation und anschließender Sublimation wird Glycolid in Reinheiten (>99,9 %) erhalten, die bei der ringöffnenden Polymerisation konsistent hochmolekulare Polymere liefern.[13]
Anwendungen
1,4-Dioxan-2,5-dion kann in einer ringöffnenden Polymerisation als dimerer cyclischer Ester sowohl kationisch[14] als auch anionisch[15], bevorzugt unter Katalyse mit organischen Zinn-Verbindungen, wie z. B. Zinndioctoat (Zinn(II)-2-ethylhexanoat),[16] oder mit basischen Alkoxiden, wie z. B. Aluminiumisopropoxid[15] in einer intramolekularen Umesterung zu Polyglycolid (Polyhydroxyessigsäure oder Polyglycolsäure PGA) polymerisiert werden.

PGA ist ein kristallines, thermoplastisches und bioabbaubares Polymer mit hoher mechanischer Stabilität und interessanten Barriereeigenschaften für industrielle und medizinische Anwendungen.[17]
Einzelnachweise
- Eintrag zu GLYCOLIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Oktober 2021.
- C.A. Bischoff, P. Walden: Ueber Derivate der Glycolsäure. In: Liebigs Ann. Chem. Band 279, Nr. 1–2, 1894, S. 45–70, doi:10.1002/jlac.18942790106.
- R.C. Weast: CRC Handbook of Chemistry and Physics, 61st Edition. CRC Press, Inc., 1980, ISBN 0-8493-0461-X, S. C-343.
- Datenblatt Glycolide bei Sigma-Aldrich, abgerufen am 23. Dezember 2019 (PDF).
- C.L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier, 2014, ISBN 978-0-323-28659-6, S. 269.
- C.-C. Lin, K.S. Anseth: Chapter II.4.3. The biodegradability of biodegradable polymeric biomaterials in Handbook of Biodegradable Polymers. Hrsg.: B.D. Ratner, A.S. Hoffman, F.J. Schoen, J.E. Lemons. Academic Press, 2012, ISBN 978-0-12-374626-9, S. 716–727.
- KUREDUX(R), Polyglycolic Acid (PGA) Resin. (PDF; 767 KB).
- W. Heintz: Pogg. Ann. Chem. u. Phys. Band 109, 1860, S. 484.
- F. Andreas, R. Sowada, J. Scholz: Darstellung und Eigenschaften von Glycolid. In: J. Prakt. Chem. Band 18, Nr. 3–4, 1962, S. 141–149, doi:10.1002/prac.19620180305.
- C.A. Bischoff, P. Walden: Ueber das Glycolid und seine Homologen. In: Ber. dt. chem. Ges. Band 26, Nr. 1, 1893, S. 262–265, doi:10.1002/cber.18930260158.
- A. Sporzynski, W. Kocay, H.V.A. Briscoe: A new method of preparing glycollide. In: Rec. Trav. Chim. Pays-Bas. Band 68, Nr. 7, 1949, S. 613–618, doi:10.1002/recl.19490680705.
- Patent US8722908B2: Method for producing glycolide. Angemeldet am 16. Dezember 2010, veröffentlicht am 13. Mai 2014, Anmelder: Kureha Corp., Erfinder: S. Suzuki, K. Yamane, M. Kagoshima, M. Kikuchi.
- Patent US3597450: Preparation of glycolide polymerizable into polyglycolic acid of consistently high molecular weight. Angemeldet am 5. November 1969, veröffentlicht am 3. August 1971, Anmelder: American Cyanamid Co., Erfinder: E.E. Schmitt, R.A. Polistina, M. Epstein, D.A. DeProspero.
- H. Amine, O. Karima, B.M. El Amine, M. Belbachir, R. Meghabar: Cationic Ring Opening Polymerization of Glycolide Catalysed by a Montmorillonite Clay Catalyst. In: J. Polym. Res. Band 12, Nr. 5, 2005, S. 361–365, doi:10.1007/s10965-004-0004-1.
- O. Dechy-Cabaret, B. Martin-Vaca, D. Bourissou: Controlled ring-opening polymerization of lactide and glycolide. In: Chem. Rev. Band 104, Nr. 12, 2004, S. 6147–6176, doi:10.1021/cr040002s.
- S. Dutta, W.-C. Hung, B.-H. Huang, C.-C. Lin: Recent developments in metal-catalyzed ring-opening polymerization of lactides and glycolides: Preparation of polylactide, polyglycolide, and poly(lactide-co-glycolide). In: Adv. Polym. Sci. Band 245. Springer, 2012, ISBN 978-3-642-27153-3, S. 219–284, doi:10.1007/978-3-642-27154-0.
- KUREDUX(R), Polyglycolic Acid (PGA) Resin, For Packaging and Industrial Applications (PDF).
