Philadelphia-Chromosom
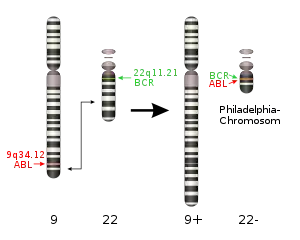
Das Philadelphia-Chromosom (veraltet Ph1) ist ein verkürztes Chromosom 22, das bei manchen menschlichen Leukämien zu finden ist. Es entsteht durch eine Chromosomentranslokation zwischen den Chromosomen 9 und 22. Die zytogenetische Schreibweise für die Translokation lautet: t(9;22)(q34;q11).
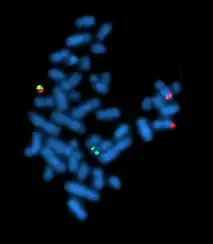
Das Philadelphia-Chromosom wurde erstmals 1960 durch Peter Nowell und David Hungerford in Philadelphia in Leukämiezellen eines Patienten mit chronischer myeloischer Leukämie (CML) beschrieben und erhielt seinen Namen vom Ort der Entdeckung.[1] Es war die erste identifizierte Chromosomenveränderung, die mit der Entstehung von Krebs in Verbindung gebracht werden konnte. Bei mehr als 95 Prozent der CML-Patienten ist die Veränderung nachweisbar.[2] Später wurde entdeckt, dass es auch bei einem Teil der Patienten mit akuter lymphatischen Leukämie (ALL) zu finden ist (etwa bei 4 % der Fälle bei Kindern und 25 % bei Erwachsenen), sehr selten auch bei der akuten myeloischen Leukämie (AML; bei weniger als ein Prozent der Fälle[3]).
Entstehung und Folgen
Translokation
Die Chromosomenveränderung findet im Knochenmark in einer Stammzelle des Blutes statt. Dabei bricht das Chromosom 9 im Bereich q34.1 (q benennt den langen Chromosomenarm, 34.1 die Position auf diesem) und das Chromosom 22 auf q11.2.[4] Die Bruchstelle liegt auf beiden Chromosomen im Bereich von Genen, dem ABL-Gen (oder ABL1; für Abelson Murine Leukemia Viral Oncogene Homolog 1) auf dem Chromosom 9 und dem BCR-Gen („breakpoint cluster region“; benannt aufgrund der häufigen Brüche in diesem Gen) auf dem Chromosom 22.
Bei der Translokation wird der 5'-Anteil des BCR-Gens mit dem 3'-Teil des ABL-Gens verknüpft. Dabei gibt es verschiedene mögliche Bruchpunkte im BCR-Gen, aber nur einen Bruchpunkt im ABL-Gen, sodass verschieden große Fusionsgene entstehen, bei denen der Anteil des ABL-Gens immer gleich ist, die Größe des BCR-Anteils aber variiert. Auf diese Weise kommt es zur Bildung der Fusionsgene BCR-ABL auf Chromosom 22 und ABL-BCR auf Chromosom 9, das in seiner nun verlängerten Form als 9q+ bezeichnet wird.[5] Bei den sogenannten philadelphia-positiven Leukämien (meist CML) ist die Chromosomentranslokation bei einer zytogenetischen Untersuchung als verkürztes Chromosom 22, eben dem hier beschriebenen Philadelphia-Chromosom, sichtbar. Auch über eine spezifische Polymerase-Kettenreaktion kann das Gen festgestellt werden.
Die Ursache dieser Chromosomenveränderung ist in den meisten Fällen nicht bekannt oder nicht feststellbar. In sehr wenigen Fällen kommt als Ursache ein Strahlenunfall (Ionisierende Strahlung) oder auch Benzol in Betracht.
Genprodukt
Durch die gegenseitige (reziproke) Translokation t(9;22) (q34;q11) sowie die neuen Fusionsgene kommt es zu einem veränderten Genprodukt bei beiden Chromosomen. Das auf dem Chromosom 22 neu entstandene BCR-ABL-Gen wird in der Zelle transkribiert, wodurch als neues Protein BCR-ABL-Genprodukt entsteht, ein Fusionsprotein. Die Translation der entstehenden mRNA führt zur Synthese des veränderten Proteins. Das ursprünglich durch das ABL-Gen transkribierte Enzym ist eine Tyrosinkinase und spielt eine wichtige Rolle bei der zellulären Wachstumsregulation. Das Fusionsprotein besteht aus dem Aminoende des BCR-Proteins und dem Carboxyende des ABL-Proteins, welches eine Kinasedomäne enthält. Dadurch wird die Tyrosinkinase-Aktivität unter dem Einfluss der BCR-Region dauerhaft aktiviert und die betroffene Zelle vermehrt sich unkontrolliert (mangelhafte Apoptose). Über diese Entwicklung wird die Zelle zu einer Tumorzelle.
Der konkrete Mechanismus, wie das neue Fusionsgen zur unkontrollierten Proliferation führt, ist bislang noch nicht vollständig aufgeklärt. Im Normalfall besitzt das ABL-Gen zwei einleitende Exons 1a und 1b, die bei der Transkription alternativ genutzt werden können. Die Auswahl findet beim Spleißen mit dem Exon 2 statt, das eine so genannte splice acceptor site besitzt und hier entweder 1a oder 1b andocken lässt. Bei der Translokation wird das Exon 1 mit dem Bruchstück des BCR ausgetauscht, das ebenfalls vom Exon 2 akzeptiert und dem Gen angefügt und somit gemeinsam mit den Exons 2 bis 11 des ABL transkribiert wird.
Onkogene Wirkung
Siehe Hauptartikel Chronische myeloische Leukämie und Akute lymphatische Leukämie
Durch die veränderte Tyrosinkinase-Aktivität des ABL-Gens unter Einfluss der BCR-Region vermehrt sich die betroffene Zelle unkontrolliert und wird zu einer Tumorzelle. Als pluripotente Stammzelle produziert sie unterschiedliche Zelltypen, die ebenfalls das veränderte Chromosom enthalten. So enthalten alle von dieser Stammzelle abstammenden Zellen das veränderte Chromosomenpaar 9 und 22 und damit das Philadelphia-Chromosom. Zu einer pathologischen Wirkung kommt es allerdings nur bei den leukämisch veränderten weißen Blutkörperchen.
Da ABL ebenso wie andere Versionen des ABL-Gens (zu v-ABL siehe unten) durch eine Veränderung der Anfangssequenz zu einem Onkogen wird, spricht man von einem Proto-Onkogen. Ähnlich wie bei anderen zu Tumorerkrankungen führenden Translokationen entsteht hier ein Onkogen durch Fusion zweier normaler Gene.
Das Fusionsprotein bindet an verschiedene andere Proteine, darunter etwa das Kinaseregulatorprotein CRK (CT10 regulator of kinase), die Phosphatidylinsitol-3'-Kinase sowie GRB-2/SOS-1. Durch die Bindung an Letzteres wird die Aktivierung des RAS-Gens, welches eine zentrale Rolle bei der Kontrolle des Zellwachstums und der Zellvermehrung einnimmt, verstärkt. RAS-Mutationen wiederum gelten als zentrale Auslöser von verschiedenen Tumoren und könnten auch bei der onkogenen Wirkung des BCR-ABL-Gens eine zentrale Rolle spielen.[6]
Variationen und zusätzliche Chromosomenveränderungen
Im Detail unterscheiden sich die Translokationen, die zur chronischen myeloischen Leukämie (CML) und zur akuten lymphatischen Leukämie (ALL) führen, an der Position des Bruches im BCR-Gen des Chromosoms 22 und damit auch in der Länge des später entstehenden BCR-ABL-Genprodukts. Der Bruch im Chromosom 9 liegt immer im gleichen Intron. Der Bruchpunkt im Chromosom 22 dagegen variiert. In der BCR-Region sind bislang drei Bruchpunkte beschrieben. Sie werden m-BCR (minor), M-BCR (Major) und µ-BCR (mikro) genannt. Der Bruchpunkt m-BCR liegt am weitesten 5'. Das daraus resultierende Fusionsprotein ist daher mit ca. 190 kDa am kleinsten. Der Bruchpunkt M-bcr liegt weiter 3' und führt zu einem Fusionsprotein mit 210 kDa Größe. Der Bruchpunkt µ-BCR liegt am weitesten 3' und führt zu dem größten BCR-ABL-Fusionsprotein mit 230 kDa.
Fusionsgene, Leukämien und Zytogenetischer Status
In der Literatur sind somit drei verschiedene BCR-abl Fusionsgene beschrieben. Das Ph-Chromosom kommt nicht nur bei der CML vor, sondern auch in etwa 20 Prozent der untersuchten Fälle bei der ALL des Erwachsenen, in fünf Prozent der untersuchten Fälle bei der ALL des Kindes und in etwa zwei Prozent der Fälle bei einer AML. Zudem haben manche der untersuchten Patienten mit einer CML oder einer adulten Form der ALL kein Ph-Chromosom, aber es kann ein Fusionsgen nachgewiesen werden. Außerdem gibt es eine geringe Anzahl von Patienten mit einer CML, die weder ein Ph-Chromosom haben, noch ein Fusionsgen exprimieren.[7]
Chronische myeloische Leukämie
90 bis 95 Prozent der Patienten mit einer chronischen myeloischen Leukämie (CML) weisen ein Ph-Chromosom auf. Über 99 Prozent aller Patienten mit einer CML exprimieren das 210-kD-Fusionsprotein. Etwa fünf Prozent der Patienten mit einer CML sind Ph-negativ, von diesen wird in fast 100 Prozent der untersuchten Fälle ebenfalls das 210-kD-Fusionsprodukt exprimiert.[8][9] Somit ist bei der CML meist die etwa in der Mitte des BCR-Gens liegende so genannte Major-BCR-Region. betroffen, die etwa 5,8 kb des insgesamt über 90 kb großen Gens ausmacht. Das resultierende Genprodukt hat eine Masse von 210 kDa (P210) gegenüber der Masse von 145 kDa des ursprünglichen ABL-Proteins, wobei 140 kDa auf ABL und 70 kDa auf BCR entfallen.
Akute lymphatische Leukämie des Erwachsenen
Bei ca. 20 Prozent der erwachsenen Patienten mit einer ALL findet man mit zytogenetischen Untersuchungsverfahren ein Ph-Chromosom. Dabei bricht das bcr-Gen in 20–50 Prozent der Fälle im ersten Intron (minor-bcr-Region) und das Genprodukt des Fusionsgens ist nur 185 kDa lang, von denen 45 kDa auf BCR entfallen. In 50–80 Prozent der Fälle ist der M-BCR-Bruchpunkt betroffen. Dies führt zu dem auch bei der CML meist vorkommenden 210-kD-Fusionsprotein. Etwa 10 Prozent der erwachsenen Patienten mit einer ALL sind Ph-negativ, exprimieren aber ein BCR-abl-Fusionsgen. In diesen seltenen Fällen werden die 190 kDa- und 210 kDa-Form etwa gleich oft gefunden.[10][11][12]
Akute lymphatische Leukämie des Kindesalters
Bei der ALL des Kindes findet man in fünf Prozent der untersuchten Fälle ein Ph-Chromosom. Diese Kinder mit einer Ph-positiven ALL exprimieren dabei in 10 Prozent der untersuchten Fälle das 210 kDa-Fusionsprotein und in 90 Prozent das 190 kDa-Protein. Die Konstellation einer ph-negativen kindlichen ALL mit Nachweis des Bcr-Abl-Fusionsproteins ist nicht bekannt.
Akute myeloische Leukämie
Etwa zwei Prozent der untersuchten Fälle von Patienten mit einer AML zeigen zytogenetisch ein Ph-Chromosom. Bei diesen seltenen Fällen kommen die Fusionsproteine p210 und p190 etwa gleich häufig vor. In sehr seltenen Fällen findet man Patienten mit einer Ph-negativen AML, die ein Bcr-Abl-Fusionsgen exprimieren.[13]
Sonstige Befunde
Patienten, die ein Philadelphia-Chromosom besitzen, weisen in den betroffenen Zellen häufig zudem weitere veränderte und vermehrte Chromosomen auf, entwickeln also so genannte somatische Aneuploidien. So konnte in klinischen Studien von 67 CML-Patienten bei fast 50 Prozent der Untersuchten (33) ein zusätzliches Philadelphia-Chromosom und bei 28 eine Trisomie des langen Arms des Chromosom 17 ermittelt werden. Neben diesen beiden Formen kamen weitere Aneuploidien der Zellen vor.[14]
Vergleichbare Onkogene
Vergleichbar mit der onkogenen Wirkung der Genveränderung beim Philadelphia-Chromosom ist die Wirkung des Abelson-Maus-Leukämie-Virus, eines Retrovirus, das Leukämien an B-Lymphozyten von Mäusen verursacht. Auch hier wird ein ABL-Gen (v-ABL) durch ein weiteres Gen, in diesem Fall das GAG-Gen des Virus, verändert und zu einer erhöhten Tyrosinkinase-Aktivität angeregt. Aufgrund der Ähnlichkeit der genetischen Veränderung werden entsprechend erkrankte Mäuse als Modellorganismen für die Entwicklung von Präparaten gegen die onkogene Wirkung der Chromosomenveränderung in der Pharmaforschung sowie zur Grundlagenforschung eingesetzt.
Forschungsgeschichte
Das Philadelphia-Chromosom wurde im Jahre 1960 von Peter Nowell von der University of Pennsylvania School of Medicine und David Hungerford vom Fox Chase Cancer Center’s Institute for Cancer Research als erste konstant auftretende chromosomale Veränderung in Tumorzellen beschrieben, und zwar bei Patienten mit chronischer myeloischer Leukämie[15]. Sie fanden ein sehr kurzes Chromosom, welches sie erst für das Y-Chromosom hielten, in den Blutproben von zwei Patienten. Später stellte sich heraus, dass es sich um das verkürzte Chromosom 22 handelte, welches nach dem Ort seiner Entdeckung als Philadelphia-Chromosom (abgekürzt Ph1) benannt wurde.[16] In einem kürzlich erschienenen Bericht schildert PC Nowell seine persönlichen Erinnerungen an die Entdeckung des Philadelphia-Chromosoms.[17]
Im Jahre 1972 konnte Janet Rowley zeigen, dass dieses Chromosom durch einen Austausch von genetischem Material zwischen den langen Armen von Chromosom 9 und Chromosom 22 entsteht.[18]
In den Jahren 1983 und 1984 wurde entdeckt, dass sich an den Chromosomenbruchstellen zwei Gene befinden (ABL und BCR), die durch die Chromosomentranslokation miteinander fusioniert werden.[19][20]
Die pharmakologische Forschung bemühte sich in der Folge, die onkogene Wirkung des veränderten Genprodukts zu blockieren. Mit Hilfe von Imatinib, einem in den 1980er Jahren entwickelten Hemmer der BCR-ABL-Tyrosinkinase, ist es heute möglich, bei der CML länger andauernde Remissionen zu erreichen.
Quellen und weiterführende Informationen
Einzelnachweise
- P. C. Nowell, D. A. Hungerford: Chromosome studies on normal and leukemic human leukocytes. In: J Natl Cancer Inst. 1960; 25, S. 85–109. PMID 14427847
- Czerwenka u. a. 2003, S. 170.
- Bain 1999, S. 83.
- Miller & Therman 2001, S. 408.
- R. Kurzrock u. a.: Philadelphia Chromosome-positive leukemias: from basic mechanisms to molecular therapeutics. In: Ann Intern Med. 2003;138, S. 819–830. PMID 12755554. (Review, Free Full Text).
- Czerwenka u. a. 2003, S. 170–171.
- R. Kurzrock u. a.: BCR rearrangement-negative chronic myelogenous leukemia revisited. In: J Clin Oncol. 2001 Jun 1;19(11), S. 2915–2926. PMID 11387365
- R. Kurzrock u. a.: Philadelphia chromosome-negative chronic myelogenous leukemia without breakpoint cluster region rearrangement: a chronic myeloid leukemia with a distinct clinical course. In: Blood. 1990 Jan 15;75(2), S. 445–452. PMID 2403827
- R. Kurzrock u. a.: Rearrangement in the breakpoint cluster region and the clinical course in Philadelphia-negative chronic myelogenous leukemia. In: Ann Intern Med. 1986 Nov;105(5), S. 673–679. PMID 3094418
- R. Kurzrock u. a.: A novel c-abl protein product in Philadelphia-positive acute lymphoblastic leukaemia. In: Nature. 1987 Feb 12-18;325(6105), S. 631–635. PMID 3543692
- R. Kurzrock u. a.: Molecular analysis of chromosome 22 breakpoints in adult Philadelphia-positive acute lymphoblastic leukaemia. In: Br J Haematol. 1987 Sep;67(1), S. 55–59. PMID 3478080
- J. Erikson u. a.: Heterogeneity of chromosome 22 breakpoint in Philadelphia-positive (Ph+) acute lymphocytic leukemia. In: Proc Natl Acad Sci U S A. 1986 Mar;83(6), S. 1807–1811. PMID 3513189
- R. Kurzrock u. a.: Expression of c-abl in Philadelphia-positive acute myelogenous leukemia. In: Blood. 1987 Nov;70(5), S. 1584–1588. PMID 3311207.
- David T. Suzuki, Anthony J.F. Griffiths, Jeffrey H. Miller, Richard C. Lewontin: Genetik. 1. Auflage. VCH Verlagsgesellschaft, Weinheim 1993, ISBN 3-527-28030-8, S. 175.
- P. C. Nowell, D. A. Hungerford: A minute chromosome in human granulocytic leukemia. In: Science. 1960; 132, S. 1497 doi:10.1126/science.132.3438.1488 Hinweis: Die recht kurze Veröffentlichung ist Bestandteil einer Abstract-Sammlung
- P. C. Nowell: The minute chromosome (Phl) in chronic granulocytic leukemia. In: Blut. 1962 Apr;8, S. 65–66. PMID 14480647
- P. C. Nowell: Discovery of the Philadelphia chromosome: a personal perspective. In: J Clin Invest. 2007 Aug;117(8), S. 2033–2035. PMID 17671636 (Free Full-Text)
- J. D. Rowley: A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. In: Nature. 1973; 243, S. 290. PMID 4126434
- N. Heisterkamp u. a.: Localization of the c-ab1 oncogene adjacent to a translocation break point in chronic myelocytic leukaemia. In: Nature. 1983; 306, S. 239–242. PMID 6316147
- J. Groffen u. a.: Philadelphia chromosomal breakpoints are clustered within a limited region, bcr, on chromosome 22. In: Cell. 1984; 36, S. 93–99 PMID 6319012
Literatur
- Philadelphia-Chromosom. In: Herder-Lexikon der Biologie. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3-8274-0354-5.
- Bruce Alberts, Dennis Bray, Julian Lewis, Martin Raff, Keith Roberts, James D. Watson: Molekularbiologie der Zelle. 1. korrigierter Nachdruck der 3. Auflage, VCH Verlagsgesellschaft, Weinheim 1997, ISBN 3-527-30055-4.
- Barbara J. Bain: Leukaemia Diagnosis. 2. Auflage. Blackwell Science, Oxford 1999, ISBN 0-632-05165-5.
- Klaus Czerwenka, Mahmood Manavi, Kerstin Pischinger: Einführung in die Molekularbiologie. Verlag Wilhelm Maudrich, Wien 2003, ISBN 3-85175-796-3.
- Ricky Lewis: Human Genetics. Concepts and Applications. Wm. C. Brown Publishers, Dubuque 1994, ISBN 0-697-13315-X.
- Orlando J. Miller, Eeva Therman: Human Chromosomes. 4. Auflage. Springer-Verlag, New York 2001, ISBN 0-387-95046-X.
- Wilhelm Seyffert: Lehrbuch der Genetik. Spektrum Akademischer Verlag, 2003.
- Friedrich Vogel, Arno G. Motulsky: Human Genetics. 3. Auflage. Springer-Verlag, Berlin/ Heidelberg 1997, ISBN 3-540-60290-9.