Oxoalkohole
Oxoalkohole sind Alkohole, die durch katalytische Hydrierung von Aldehyden aus der Hydroformylierungsreaktion von Olefinen mit Synthesegas entstehen.
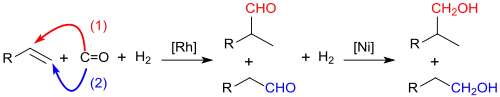
Die bei dieser von Otto Roelen[1] bei der Ruhrchemie im Jahr 1938 entdeckten, auch als Oxosynthese bezeichneten Reaktion[2] unter Kobalt-, heute überwiegend unter Rhodium-Katalyse gebildeten so genannten Oxoaldehyde können durch Aldolkondensation mit sich selbst oder bevorzugt mit Formaldehyd in α, β-ungesättigte Aldehyde überführt werden, deren Hydrierungsprodukte ebenfalls zu den Oxoalkoholen gehören.[3]
Die Gruppe der so genannten Oxoprodukte[4] umfasst neben den Oxoaldehyden und Oxoalkoholen auch die durch Oxidation daraus erhältlichen Oxosäuren, wie z. B. Valeriansäure oder 2-Ethylhexansäure.
Oxoalkohole gehören zu den großvolumigen organischen Chemikalien mit einer jährlichen globalen Produktionsmenge von ca. 8 Mio. Tonnen. Sie finden als Lösungsmittel und als Alkoholkomponenten für Ester Verwendung, die ihrerseits als Lösungsmittel, als Weichmacher für Polyvinylchlorid PVC, als Monomere (z. B. Acrylsäureester) und als Additive für Kraftstoffe und Schmieröle eingesetzt werden.
Herstellung und Verwendung
Die Hydroformylierung wurde in den vergangenen 80 Jahren hinsichtlich Energieeffizienz, Aldehydausbeute und n-/iso-Isomerenverhältnis optimiert und liefert bei relativ niedrigen Temperaturen (< 130 °C) und Drücken (< 60 MPa) Aldehydausbeuten > 95 % und n-Butanal/iso-Butanal-Verhältnisse von bis zu 97:3.[5][6]
Mehr als 90 % der so erhaltenen Aldehyde werden unter Katalyse mit Raney-Nickel oder Edelmetallen praktisch quantitativ zu den Oxoalkoholen hydriert.
Die wichtigsten Oxoalkohole sind n-Butanol und Isobutanol durch Hydroformylierung von Propen, die zusammen ca. 70 % des Gesamtvolumens der Oxoalkohole ausmachen.
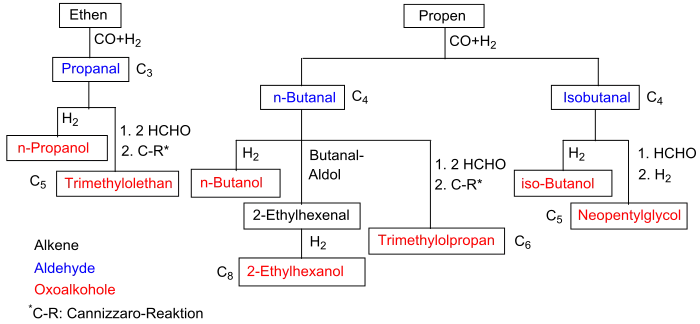
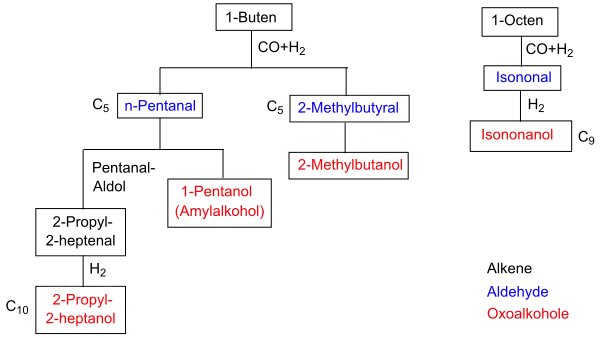
Das durch Aldolkondensation von zwei n-Butanal-Molekülen erhaltene 2-Ethylhexenal wird zum Oxoalkohol 2-Ethylhexanol 2-EH (Isooctanol) hydriert, der wegen des Verbots des PVC-Weichmachers Bis(2-ethylhexyl)phthalat DEHP in der EU stark an Bedeutung verloren hat. Als Ersatzstoffe sind die längerkettigen Oxoalkohole Isononanol INA und 2-Propyl-1-heptanol 2-PH – durch Aldolkondensation von zwei n-Pentanal-Molekülen und anschließende Hydrierung – zunehmend wichtiger geworden.
Der aus Propionaldehyd durch zweifache Addition von Formaldehyd an die 2-Position des Propanals und anschließende Cannizzaro-Reaktion zugängliche dreiwertige Alkohol Trimethylolethan ist ebenso wie das analog aus n-Butanal erhaltene Trimethylolpropan ein Vernetzer für Polyester und Polyurethane. Der analog aus Isobutanal abgeleitete zweiwertige Alkohol Neopentylglycol ist eine wichtige Alkoholkomponenten für u. a. Polyesterharze, Lacke, Schmierstoffe und Hydraulikflüssigkeiten.
Auch langkettige Alkene (z. B. aus dem SHOP-Verfahren) als Vorstufen für Fettalkohole oder Alkengemische (z. B. das beim Steamcracken anfallende so genannte Raffinat II (hauptsächlich 1-Buten und 2-Butene)) sind als Vorstufen z. B. für die Aromastoffe Essigsäurepentylester von Interesse.
Oxoalkohole eignen sich als Ausgangsverbindungen für eine Vielzahl von Carbonsäureestern, Carbonsäuren und Aminen.[4]
Die wichtigsten Hersteller für Oxoalkohole sind BASF, DuPont de Nemours, Eastman Chemical, Evonik Industries, ExxonMobil, Grupa Azoty, INEOS, LG Chem, Mitsubishi Chemical, Oxea, Perstorp AB, PetroChina, Sabic, Sasol und Sinopec.
Einzelnachweise
- Historische Stätten der Chemie, 2013-Dr. Otto Roelen und das Werk Ruhrchemie in Oberhausen. Gesellschaft Deutscher Chemiker, abgerufen am 18. April 2018.
- Patent DE849548B: Verfahren zur Herstellung von sauerstoffhaltigen Verbindungen. Veröffentlicht am 20. September 1938, Anmelder: Chemische Verwertungsgesellschaft Oberhausen m.b.H., Erfinder: O. Roelen.
- Hans-Jürgen Arpe: Industrielle Organische Chemie, 6. vollst. überarb. Auflage. Miley-VCH, Weinheim 2007, ISBN 978-3-527-31540-6, S. 137–152.
- Product Range. (PDF; 2,1 MB) In: oxea-chemicals.com. Oxea GmbH, abgerufen am 18. April 2018 (englisch).
- C.W. Kohlpaintner, R.W. Fischer, B. Cornils: Aqueous biphasic catalysis: Ruhrchemie/Rhône-Poulenc oxo process. In: Appl. Catal. A. Band 221, Nr. 1–2, 2001, S. 219–225, doi:10.1016/S0926-860X(01)00791-8.
- R. Tudor, A. Shah: Industrial low pressure hydroformylation: Forty-five years of progress for the LP OxoR process. In: Johnson Matthey Technol. Rev. Band 61, Nr. 3, 2017, S. 246–256, doi:10.1595/20565131X695875 (matthey.com).