Natriumaluminiumhydrid
Natriumaluminiumhydrid ist eine anorganisch-chemische Verbindung des Natriums aus der Stoffgruppe der Hydride.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
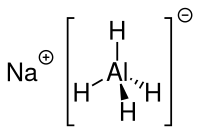 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumaluminiumhydrid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | NaAlH4 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 54,00 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,27 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Natriumaluminiumhydrid kann direkt aus den Elementen erhalten werden.[2] Die Reaktion hat eine sehr hohe Ausbeute, wenn sie bei einer Temperatur von 140 °C und einem Druck von 350 Bar in Toluol mit Triethylaluminium als Katalysator ausgeführt wird.[3]
Es kann auch durch Umsetzung von Natriumhydrid mit Aluminiumchlorid in Tetrahydrofuran hergestellt werden.[4] Bei der Reaktion wird Triethylaluminium als Katalysator eingesetzt, welches die Bildung eines löslichen Zwischenproduktes dient.[3]
Die erste Synthese gelang 1951 durch Schlesinger und Finholt durch Reaktion von Natriumhydrid mit Aluminiumbromid in Dimethylether, wobei 60 % Ausbeute erreicht wurden.[3]
Später verbesserten sie die Ausbeute durch Darstellung mit Aluminiumhydrids und Natriumhydrid in Tetrahydrofuran.[3]
Ebenfalls möglich ist die Darstellung durch Reaktion von Lithiumaluminiumhydrid oder Natriumtetrachloraluminat mit Natriumhydrid.[3]
Eigenschaften
Natriumaluminiumhydrid ist ein weißer kristalliner Feststoff, der mit Wasser heftig reagiert. Er zersetzt sich bei Erhitzung, wobei unter anderem Wasserstoff entsteht.[1] Es ist (ähnlich wie Lithiumaluminiumhydrid) ein wirksames Reduktionsmittel, reduziert unter anderem Carbonsäureester zu Aldehyden, Lactone zu Hydroxyaldehyden.[2]
Verwendung
Natriumaluminiumhydrid wird neben dem Einsatz als Reduktionsmittel auch zur Bestimmung kleiner Wassermengen in Ethern, Olefinen und Kohlenwasserstoffen verwendet.[2]
Es wird auch als Speichermedium für Wasserstoff in der Fahrzeugindustrie untersucht.[5][6]
Sicherheitshinweise
Bei Kontakt mit Wasser und Halogenkohlenwasserstoffen besteht Explosionsgefahr.[2]
Einzelnachweise
- Eintrag zu Natriumalanat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Januar 2020. (JavaScript erforderlich)
- Eintrag zu Natriumaluminiumhydrid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Januar 2015.
- H.J. Emeléus & A.G. Sharpe: ADVANCES IN INORGANIC CHEMISTRY AND RADIOCHEMISTRY. Academic Press, 1966, ISBN 978-0-08-057857-6, S. 319 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu SODIUM ALUMINUM HYDRIDE in der Hazardous Substances Data Bank, abgerufen am 26. Januar 2015 (online auf PubChem).
- Sven Geitmann: Energiewende 3.0: mit Wasserstoff und Brennstoffzellen. Hydrogeit Verlag, 2012, ISBN 978-3-937863-16-0, S. 105 (eingeschränkte Vorschau in der Google-Buchsuche).
- Vitalie Stavila, Raghunandan K. Bhakta, Todd M. Alam, Eric H. Majzoub, Mark D. Allendorf: Reversible Hydrogen Storage by NaAlH Confined within a Titanium-Functionalized MOF-74(Mg) Nanoreactor. In: ACS Nano. 6, 2012, S. 9807–9817, doi:10.1021/nn304514c.


