n-Butylamin
n-Butylamin ist eine chemische Verbindung, die in der chemischen und pharmazeutischen Industrie als Zwischenprodukt bei der Synthese von organischen Stoffen entsteht. Es ist ein primäres Amin. n-Butylamin gehört zur Gruppe der aliphatischen Amine, genauer der Butylamine und ist isomer zu Isobutylamin, sec-Butylamin und tert-Butylamin.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||||||||
| Name | n-Butylamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H11N | |||||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit charakteristischem, ammoniakartigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 73,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,74 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
78 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,4031 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Der Trivialname Norvalamin ist von der Aminosäure Norvalin abgeleitet. Durch Decarboxylierung von Norvalin entsteht n-Butylamin.
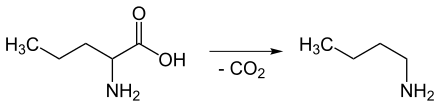 Decarboxylierung von Norvalin zu n-Butylamin
Decarboxylierung von Norvalin zu n-Butylamin
Vorkommen
n-Butylamin kommt natürlich in einigen Früchten (wie zum Beispiel Tomaten) und Nahrungsmitteln vor.[7]
Gewinnung und Darstellung
n-Butylamin entsteht bei der Umsetzung von n-Butanol oder n-Butanal mit Ammoniak in Anwesenheit von Katalysatoren.[7] Ferner lässt es sich durch die sogenannte Schmidt-Reaktion aus Valeriansäure erzeugen.[8]
Eigenschaften
Sicherheitstechnische Kenngrößen
n-Butylamin bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −14 °C.[1][9] Der Explosionsbereich liegt zwischen 1,7 Vol.‑% (50 g·m−3) als untere Explosionsgrenze (UEG) und 10 Vol.‑% (304 g·m−3) als obere Explosionsgrenze (OEG).[1] Die Grenzspaltweite wurde mit 0,92 mm bestimmt.[1][9] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[1] Die Zündtemperatur beträgt 310 °C.[1][9] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
n-Butylamin ist ein Zwischenprodukt bei der Herstellung von verschiedenen organischen Verbindungen wie Farbstoffen, Arzneistoffen, Pflanzenschutzmitteln, Weichmachern, Emulgatoren, Korrosionsschutzmitteln, Klebstoffen und kann als Lösungsmittel bei der Titration eingesetzt werden.[10] Es wird auch als Aromastoff in Lebensmitteln eingesetzt.[11]
Sicherheitshinweise
Der Kontakt mit der Flüssigkeit oder deren Lösungen kann akut zu Verätzungen der Haut oder Augen führen.[1] n-Butylamin wirkt reizend beim Einatmen.
Einzelnachweise
- Eintrag zu Butylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. April 2019. (JavaScript erforderlich)
- www.chemistryworld.de
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-76.
- Eintrag zu Butylamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 109-73-9 bzw. N-Butylamin), abgerufen am 2. November 2015.
- Datenblatt N-Butylamin (PDF) bei Merck, abgerufen am 19. Januar 2011.
- George A. Burdock: Fenaroli's Handbook of Flavor Ingredients, Fourth Edition. CRC Press, 2001, ISBN 978-1-4398-6327-5, S. 186 (eingeschränkte Vorschau in der Google-Buchsuche).
- Heinz Becker, Werner Berger, Günter Domschke: Organicum Practical Handbook of Organic Chemistry. Elsevier, 2013, ISBN 978-1-4831-4628-7, S. 598 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- D.R. Buhler, D.J. Reed: Nitrogen and Phosphorus Solvents. Elsevier, 2013, ISBN 978-1-4832-9020-1, S. 17 (eingeschränkte Vorschau in der Google-Buchsuche).
- George A. Burdock: Encyclopedia of Food and Color Additives. CRC Press, 1997, ISBN 978-0-8493-9412-6, S. 320 (eingeschränkte Vorschau in der Google-Buchsuche).


