Mycophenolat-Mofetil
Mycophenolat-Mofetil (auch Mykophenolatmofetil oder Mykophenolat-Mofetil, MMF) ist ein Arzneistoff, der die Wirkung des Immunsystems unterdrückt (Immunsuppressivum). Es wird vor allem in Kombination mit Ciclosporin und Corticosteroiden zur Prophylaxe von akuten Transplantatabstoßungsreaktionen bei Patienten mit allogener Nieren-, Herz- oder Lebertransplantation eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
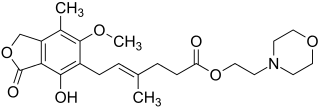 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Mycophenolat-Mofetil | |||||||||||||||||||||
| Andere Namen |
(E)-6-(-4-Hydroxy-6-methoxy-7-methyl-3-oxo-1,3-dihydroisobenzofuran-5-yl)-4-methylhex-4-ensäure-2-morpholinoethylester (IUPAC) | |||||||||||||||||||||
| Summenformel | C23H31NO7 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis fast weißes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L04AA06 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 433,50 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, leicht löslich in Aceton, wenig löslich in absolutem Ethanol[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Mycophenolat-Mofetil wurde von dem Pharmazieunternehmen Syntex entwickelt. Nach der Übernahme durch Roche wurde es im Mai 1995 unter dem Namen CellCept in den USA zugelassen. In Europa war es eines der ersten Medikamente, das in einem zentralen Zulassungsverfahren für 15 Länder zugelassen wurde.
Pharmakologie
Wirkungsmechanismus
Mycophenolat-Mofetil ist der 2-Morpholinoethylester der Mycophenolsäure (MPA) und wird im Körper in diese umgewandelt. MPA ist ein selektiver, nicht-kompetitiver und reversibler Hemmer der Inosinmonophosphat-Dehydrogenase (IMPDH), der daher die Synthese der Guanin-enthaltenen Nukleotide (Guanosin) hemmt. Da für die Proliferation von T- und B-Lymphozyten die De-novo-Synthese von Purinen unerlässlich ist, während andere Zellarten den Wiederverwertungsstoffwechsel benutzen können, wirkt MPA stärker zytostatisch auf Lymphozyten als auf andere Zellen, wodurch diese selektiv gehemmt werden.
Nebenwirkungen
Mycophenolat-Mofetil hat zahlreiche Nebenwirkungen. Häufigere Nebenwirkungen (bei über 10 % der Patienten) sind Anämie, Thrombozytopenie, Übelkeit, Erbrechen und Durchfall. Infolge der Unterdrückung des Immunsystems können vermehrt Infektionen (Sepsis, Candidose, Herpes simplex, Herpes zoster) auftreten.
Bei Kindern von Frauen, die während der Schwangerschaft mit CellCept in Kombination mit anderen Immunsuppressiva behandelt wurden, wurde über angeborene Missbildungen berichtet.[4] Die Anwendung von CellCept während der Schwangerschaft sollte auf die Fälle beschränkt werden, bei denen keine geeignete Alternative zur Verfügung steht. In einigen Fällen wurde eine Progressive multifokale Leukenzephalopathie (PML) als lebensbedrohliche, neurologische Nebenwirkung beobachtet.[5]
Im Februar 2016 informierte Novartis in einem Rote-Hand-Brief zu Myfortic® (Mycophenolat-Natrium; i.e. gleicher aktiver Metabolit) und das schwerwiegende Risiko für Teratogenität.[6]
Weblinks
- Artikel aus dem Ärzteblatt (22. März 1996) über die Zulassung von CellCept
- FDA Information
Einzelnachweise
- Datenblatt MYCOPHENOLATE MOFETIL CRS (PDF) beim EDQM, abgerufen am 15. August 2008.
- Eintrag zu Mycophenolatmofetil. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Oktober 2014.
- Datenblatt Mycophenolate mofetil, ≥98% (HPLC) bei Sigma-Aldrich, abgerufen am 31. Oktober 2016 (PDF).
- Rote-Hand-Brief zu CellCept, 12. November 2007 (PDF; 91 kB).
- Rote-Hand-Brief zu CellCept, 18. Februar 2008 (PDF; 111 kB).
- RHB von Novartis auf der WebSite der Arzneimittelkommission der deutschen Ärzteschaft, abgerufen am 1. März 2016.