Molnupiravir
Molnupiravir (Entwicklungscodes MK-4482 und EIDD[4]-2801) ist ein antiviraler Arzneistoff, der durch die Pharmaunternehmen Merck Sharp & Dohme (MSD) und Ridgeback Biotherapeutics zur oralen ambulanten Behandlung von milden bis mäßigen Verläufen von COVID-19 entwickelt wird.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
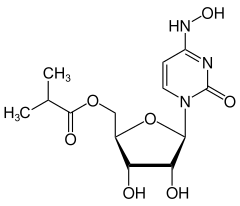 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Molnupiravir[1] | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C13H19N3O7 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus |
Viruzid | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 329,31 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Löslichkeit |
leicht löslich in DMF und DMSO (jeweils 30 g·l−1 bei 20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Ursprünglich wurde Molnupiravir im Rahmen der Arzneimittelforschung an der Emory University in Atlanta (Georgia, USA) zur Behandlung der Grippe (Influenza) untersucht.[5]
Zulassung
Am 4. November 2021 hat die britische Arzneimittelbehörde MHRA Molnupiravir zur Behandlung von leichtem bis moderaten COVID-19 bei Personen mit Risikofaktoren wie Diabetes, Fettleibigkeit oder Lungen- und Herzkrankheiten sowie bei älteren Personen ab 60 Jahren unter dem Namen Lagevrio bedingt zugelassen.[6][7]
In den USA erteilte die FDA am 22. Dezember 2021 eine Notfallzulassung.[8] Zuvor hatte sich das zuständige Prüfgremium der FDA mit einer knappen Mehrheit von 13 zu 10 dafür ausgesprochen. Insbesondere hohe Nebenwirkungen und mögliche Fluchtmutationen wurden kritisiert.[9] Auch in Japan wurde Molnupiravir im Dezember 2021 für den Notfallgebrauch zugelassen.[10]
In der EU hat Molnupiravir bisher (Stand März 2022) keine Zulassung. Die Europäische Arzneimittel-Agentur (EMA) unterstützt aber bereits den Einsatz von Molnupiravir bei Notfällen, das heißt bei nicht beatmungspflichtigen Covid-19-Patienten, die ein erhöhtes Risiko haben, schwer zu erkranken. Das von der Agentur erstellte Gutachten kann zur Unterstützung von Genehmigungen durch nationale Behörden für die frühzeitige Verwendung des Arzneimittels noch vor der Marktzulassung herangezogen werden.[11][12] So ist etwa in Deutschland seit dem 3. Januar 2022 die Verordnung und Abgabe von Molnupiravir (Lagevrio) möglich. Aufgrund einer vom Bundesministerium für Gesundheit erlassenen Allgemeinverfügung kann die Bundesregierung das Mittel vorübergehend auch ohne Marktzulassung im Geltungsbereich des Arzneimittelgesetzes legal beschaffen und in Verkehr bringen.[13] Zuvor hatte schon im Dezember 2021 in Dänemark die Gesundheitsbehörde ebenfalls die Anwendung des nicht marktzugelassenen Mittels genehmigt.[14][15]
Die EMA hat im November 2021 das Zulassungsverfahren begonnen.[16]
Wirkung
Molnupiravir ist ein Prodrug, ein inaktiver oder wenig aktiver pharmakologischer Stoff, der erst durch Verstoffwechselung (Metabolisierung) im Organismus zu einem aktiven Wirkstoff (Metaboliten) wird. Durch Hydrolyse entsteht das synthetische Nukleosid-Analogon N4-Hydroxycytidin (NHC), das antiviral durch Einführung von Kopierfehlern bei der viralen RNA-Replikation durch virale RNA-Polymerase wirkt. In mehreren Studien wurde diese Wirkung gegen Coronaviren wie SARS-CoV, MERS-CoV und SARS-CoV-2 belegt.
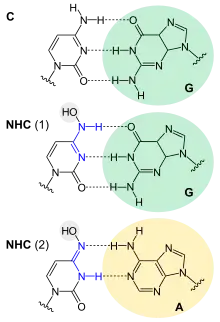
NHC ähnelt dem Nukleosid Cytidin, von dem es sich durch eine zusätzliche OH-Gruppe unterscheidet.[17] NHC existiert in zwei als Tautomere bezeichneten Formen, die sich durch eine Bindungsverschiebung und Protonenwanderung ineinander umwandeln. Dadurch kann NHC sowohl mit Guanosin als auch mit Adenosin Basenpaare bilden und erzeugt so Mutationen im Erbgut. Wirkt NHC wie Cytidin, akzeptiert die Gen-Fehlerkorrektur des Virus dies. Jedoch lassen sich die Bindungen in NHC so verschieben, dass es Uridin imitiert und ein Basenpaar mit Adenosin bildet. Wird Virus-RNA vervielfältigt, wird durch die teilweise „falschen“ Basenpaarungen das Erbgut völlig verändert. Eine fehlerfreie Viren-Vermehrung damit unwahrscheinlicher, es treten zu viele Mutationen auf.
Durch diese Mutationen besteht jedoch auch die Gefahr, dass es zu einer Fluchtmutation (Escape Variante) kommt, gegen die etwa auch die verfügbaren Impfstoffe nicht mehr wirken. „Das wäre katastrophal für die ganze Welt“, mahnte der amerikanische Immunologe James Hildreth, CEO des Meharry Medical College.[9]
Molnupiravir ähnelt strukturell anderen Nukleosidanaloga wie z. B. Remdesivir[5], führt aber anders als Remdesivir nicht zu einem Kettenabbruch bei der DNA-Synthese, der Wirkmechanismus ist wie oben beschrieben ein vollkommen anderer.
Da Molnupiravir bereits in Tierversuchen Schäden an Ungeborenen hervorgerufen hatte,[9] ist sein Einsatz bei Schwangeren und gebärfähigen Frauen nicht empfohlen[18] bzw. kontraindiziert;[19] gebärfähige Frauen müssen eine zuverlässige Verhütungsmethode anwenden.[18]
Klinische Prüfungen
Am 19. Oktober 2020 begann MSD eine einjährige Phase-II/III-Studie bei hospitalisierten Covid-Patienten in den Vereinigten Staaten.[20] Im Oktober 2021 veröffentlichten MSD und Ridgeback Daten einer Zwischenanalyse, dass Molnupiravir das Risiko einer Krankenhauseinweisung oder eines Todesfalls um etwa 50 Prozent im Vergleich zu Placebo bei Patienten mit leichter oder mittelschwerer COVID-19 reduziert.[21] Weitere Daten, welche Ende November 2021 veröffentlicht wurden, konnten nur noch eine Risikosenkung um etwa 30 Prozent im Vergleich zur Placebo-Gruppe zeigen.[22]
Einzelnachweise
- INN Recommended List 85, World Health Organisation (WHO), 6. April 2021.
- AstaTech: SDS AT13078, abgerufen am 21. April 2021.
- Eidd-2801 (cas 2349386-89-4). In: caymanchem.com. Abgerufen am 21. April 2021 (englisch).
- EIDD steht für „Emory Institute for Drug Development“
- A. Rößler: SARS-CoV-2-Ansteckungen im Tierversuch verhindert. In: www.pharmazeutische-zeitung.de. 4. Dezember 2020.
- First oral antiviral for COVID-19, Lagevrio (molnupiravir), approved by MHRA. In: gov.uk. 4. November 2021, abgerufen am 4. November 2021.
- Großbritannien lässt Pille zur Covid-19-Behandlung zu. In: spiegel.de. 4. November 2021, abgerufen am 4. November 2021.
- Coronavirus (COVID-19) Update: FDA Authorizes Additional Oral Antiviral for Treatment of COVID-19 in Certain Adults, FDA, 23. Dezember 2021.
- Spencer Kimball: FDA authorizes Pfizer's Covid treatment pill, the first oral antiviral drug cleared during the pandemic. 22. Dezember 2021, abgerufen am 23. Dezember 2021 (englisch).
- Merck and Ridgeback’s Molnupiravir, an Investigational Oral Antiviral COVID-19 Treatment, Receives Special Approval for Emergency in Japan, Pressemitteilung MSD, 24. Dezember 2021.
- EMA unterstützt Einsatz von Corona-Pille für Notfälle. In: ntv.de. 19. November 2021, abgerufen am 20. November 2021.
- Europäische Arzneimittel-Agentur EMA: EMA issues advice on use of Lagevrio (molnupiravir) for the treatment of COVID-19. 19. November 2021, abgerufen am 20. November 2021 (englisch). Anwendungshinweise/weitere Informationen zum Stand des Zulassungsverfahrens und zum Medikament hat die EMA bereitgestellt unter Europäische Arzneimittel-Agentur EMA: Lagevrio (also known as molnupiravir or MK 4482) - COVID-19 - Article-5(3) procedure: Conditions of use, conditions for distribution and patients targeted and conditions for safety monitoring. (pdf) 19. November 2021, abgerufen am 20. November 2021.
- Verordnung von Molnupiravir trotz fehlender Zulassung. In: www.gelbe-liste.de. 3. Januar 2022, abgerufen am 3. Januar 2022.
- Denmark allows unapproved pill for at-risk Covid-19 patients in line with EMA advice, medwatch.com, 16. Dezember 2021.
- Sundhedsstyrelsens anmeldelse: Lagevrio (molnupiravir) til covid-19, Dänische Gesundheitsbehörde, 16. Dezember 2021.
- CEMA receives application for marketing authorisation for Lagevrio (molnupiravir) for treating patients with COVID 19. In: EMA. 23. November 2021, abgerufen am 3. Januar 2022 (englisch).
- Florian Kabinger et al.: Mechanism of molnupiravir-induced SARS-CoV-2 mutagenesis. In: Nature Structural & Molecular Biology. Band 28, Nr. 9, September 2021, S. 740–746, doi:10.1038/s41594-021-00651-0.
- Lagevrio - Art. 5(3) Informationen für Angehörige der medizinischen Fachkreise, BfArM, 23. Dezember 2021.
- Hinweise für den Anwendenden - Lagevrio 200 mg Hartkapseln, BfArM, 17. Dezember 2021.
- Efficacy and Safety of Molnupiravir (MK-4482) in Hospitalized Adult Participants With COVID-19 (MK-4482-001), Clinical trials. Abgerufen am 16. April 2021.
- Merck and Ridgeback’s Investigational Oral Antiviral Molnupiravir Reduced the Risk of Hospitalization or Death by Approximately 50 Percent Compared to Placebo for Patients with Mild or Moderate COVID-19 in Positive Interim Analysis of Phase 3 Study, PM Merck & Co vom 1. Oktober 2021, abgerufen am 7. Oktober 2021.
- Merck and Ridgeback Biotherapeutics Provide Update on Results from MOVe-OUT Study of Molnupiravir, an Investigational Oral Antiviral Medicine, in At Risk Adults With Mild-to-Moderate COVID-19. Abgerufen am 26. November 2021 (amerikanisches Englisch).